Silber(I,III)-oxid
Silber(I,III)-oxid ist eine anorganische chemische Verbindung des Silbers aus der Gruppe der Oxide.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Ag+/3+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Silber(I,III)-oxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | AgO | ||||||||||||||||||
| Kurzbeschreibung |
dunkelgrauer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 123,87 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
7,44 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
reagiert mit Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Silber(I,III)-oxid kann durch Persulfat-Oxidation von Silber(I)-oxid in alkalischen Medium (zum Beispiel Natriumhydroxid oder Kaliumhydroxid) bei 90 °C gewonnen werden.[2]
Andere Darstellungsmöglichkeiten sind die Reaktion einer Mischung der Lösungen von Silbernitrat und Kaliumpermanganat mit Kaliumhydroxid, die Einwirkung von ozonhaltigem Sauerstoff bei 240 °C auf metallisches Silber bei Anwesenheit eines Katalysators, die Reaktion von Natriumhypochlorit mit Silber(I)-oxid oder durch die Hydrolyse oder thermische Zersetzung von Ag7NO11, das durch anodische Oxidation von Silbernitrat-Lösungen gewonnen wird, dargestellt werden.[4]
Eigenschaften
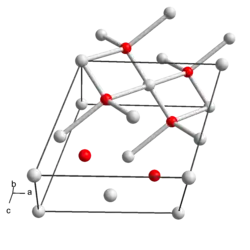
Silber(I,III)-oxid ist ein diamagnetischer[3], lichtempfindlicher, dunkelgrauer und geruchloser Feststoff, der mit Wasser reagiert.[1] Er wirkt stark oxidierend, ist löslich in Salpetersäure und zersetzt sich bei Einwirkung von Schwefelsäure unter Sauerstoffabgabe. Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14) und den Gitterparametern a = 585,2 pm, b = 347,8 pm, c = 549,5 pm und β = 107,5° sowie zwei Formeleinheiten pro Elementarzelle.[5] Als trockener Feststoff ist das Oxid bis 100 °C temperaturstabil, oberhalb beginnt die Zersetzung.[3]
Obwohl die Verbindung formal auch Silber(II)-oxid oder Silberperoxid genannt wird, weisen bisherige Nachweise aus, dass es sich um Silber(I,III)-oxid handelt. Einige der scheinbar widersprüchlichen Daten, die für AgO gemeldet wurden, können auf das fehlende genaue Verständnis der Oxidationsstufe von Silber in AgO zurückzuführen sein.[6]
Verwendung
Silber(I,III)-oxid wird in der organischen Chemie zur Umsetzung von Benzylhalogeniden direkt in Dibenzylether verwendet. Er dient auch als Oberflächen-Katalysator bei der Epoxidierung von Alkenen.[7] Silber liegt in geladenen Silber-Zink- und anderen Akkumulatoren als Silber(I,III)-oxid vor.[2][8] Bei Silberoxid-Zink-Knopfzellen wird Silber(I)-oxid oder Silber(I,III)-oxid bei der Herstellung direkt in die Zellen gepresst.[9]
Einzelnachweise
- Datenblatt Silber(II) oxide, 99.9% (metals basis), Ag 86.6% min bei AlfaAesar, abgerufen am 10. November 2021 (PDF) (JavaScript erforderlich).
- Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1461-9, S. 369 (eingeschränkte Vorschau in der Google-Buchsuche).
- N. Hammer, Jacob Kleinberg: Silver(II) oxide. In: J. C. Bailar, Jr. (Hrsg.): Inorganic Syntheses. Band 4. McGraw-Hill, Inc., 1953, ISBN 0-88275-165-4, S. 12 f. (englisch).
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 998.
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Springer DE, 1997, ISBN 3-540-60035-3, S. 288 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- T. P. Dirkse: Silver(II) Oxide, Department of Chemistry, Calvin College Grand Rapids, ;Uchigan 49506, U.S.A., April 1984
- Datenblatt Silver oxide, predominantly silver(II) oxide bei Sigma-Aldrich, abgerufen am 3. August 2013 (PDF).
- Helmut Schaefer: VDI-Lexikon Energietechnik. Springer-Verlag, 2013, ISBN 978-3-642-95748-2, S. 42 (eingeschränkte Vorschau in der Google-Buchsuche).
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren Mobile Energiequellen für heute und morgen. Springer-Verlag, 2013, ISBN 978-3-642-58741-2, S. 49 (eingeschränkte Vorschau in der Google-Buchsuche).

