Seyferth-Gilbert-Kettenverlängerung
Die Seyferth-Gilbert-Kettenverlängerung, auch als Seyferth-Gilbert-Reaktion oder Seyferth-Gilbert-Homologisierung bekannt, ist eine Namensreaktion der organischen Chemie. Sie wurde nach Dietmar Seyferth benannt, der sie 1970 veröffentlichte.[1] 1979 wurde die Reaktion von John C. Gilbert et al. genauer untersucht. Bei dieser Reaktion reagieren Aldehyde oder Ketone zu internen oder terminalen Alkinen.[2][3][4][5][6]
Übersicht
In der Gegenwart von Kalium-tert-butanolat und Dimethyl-(diazomethyl)phosphonat (auch bekannt als Seyferth-Gilbert-Reagenz) reagieren Aldehyde und Ketone zu Alkinen. Diese Reaktion wird auch Homologisierung oder Kettenverlängerung genannt, weil sich nach der Reaktion zwischen den Resten R1 und R2 genau ein Kohlenstoffatom (in der Übersicht blau markiert) mehr befindet als vorher.
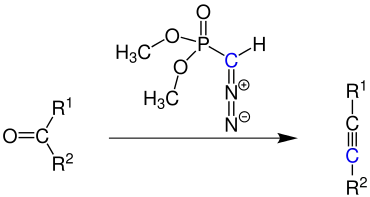
Wird ein Aldehyd als Edukt eingesetzt, erhält man ein terminales Alkin (1-Alkin). Ist das Edukt ein Keton (also R1 ≠ H ≠ R2) so liegt die C≡C-Dreifachbindung weiter im Inneren des Moleküls.
Mechanismus
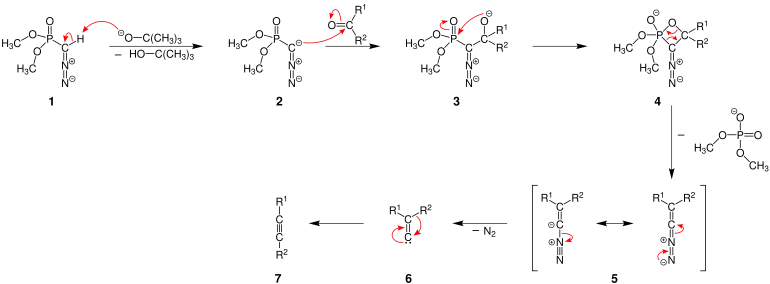
Das tert-Butanolat wirkt als Base und deprotoniert das Seyferth-Gilbert-Reagenz 1, sodass ein Carbanion 2 entsteht. Das negativ geladene Kohlenstoffatom 2 greift nun an der Carbonylgruppe des Aldehyds bzw. des Ketons an, was zur Bildung eines Alkoholats 3 führt. Es folgt ein intramolekularer Angriff des negativ geladenen Sauerstoffs 3 auf das Phosphoratom. So entsteht unter Ringschluss das Vierringintermediat 4. Unter Abspaltung eines Dimethylphosphats entsteht ein Zwischenprodukt in Form einer Diazovinylverbindung 5. Aus diesem Zwischenprodukt spaltet sich Stickstoff ab und es bildet sich ein Carben 6. Es folgt eine Umlagerung des Restes R2 und damit die Bildung eines Alkins 7 als Produkt.
Bestmann-Modifizierung
Die Seyferth-Gilbert-Reaktion wurde von Susumu Ohira und Hans Jürgen Bestmann modifiziert.[7][8] Die Generierung von Dimethyl-(diazomethyl)phosphonat in situ durch die Umsetzung von Dimethyl (1-diazo-2-oxopropyl)phosphonat (auch bekannt als Ohira-Bestmann-Reagenz) mit Methanol und Kaliumcarbonat sorgt für eine hohe Ausbeute bei der Synthese von terminalen Alkinen.[1][6][9] R entspricht auch hier wieder einem organischen Rest.

Ein Vorteil der Bestmann-Modifizierung ist, dass die Reaktionsbedingungen sehr mild sind und damit viele funktionelle Gruppen toleriert werden.[6]
Einzelnachweise
- Zerong Wang: Comprehensive organic name reactions and reagents. John Wiley & Sons, Hoboken, N.J. 2009, ISBN 978-0-471-70450-8, S. 2559–2560.
- D. Seyferth, R. S. Marmor: Dimethyl diazomethylphosphonate: its preparation and reactions. In: Tetrahedron Letters. Band 11, Nr. 28, 1970, S. 2493–2496, doi:10.1016/S0040-4039(01)98264-4.
- D. Seyferth, R. S. Marmor, P. Hilbert: Reactions of dimethylphosphono-substituted diazoalkanes. (MeO)2P(O)CR transfer to olefins and 1,3-dipolar additions of (MeO)2P(O)C(N2)R. In: J. Org. Chem. Band 36, Nr. 10, 1971, S. 1379–1386, doi:10.1021/jo00809a014.
- J. C. Gilbert, U. Weerasooriya: Elaboration of aldehydes and ketones to alkynes: improved methodology. In: J. Org. Chem. Band 44, Nr. 26, 1979, S. 4997–4998, doi:10.1021/jo00394a063.
- J. C. Gilbert, U. Weerasooriya: Diazoethenes: their attempted synthesis from aldehydes and aromatic ketones by way of the Horner-Emmons modification of the Wittig reaction. A facile synthesis of alkynes. In: J. Org. Chem. Band 47, Nr. 10, 1982, S. 1837–1845, doi:10.1021/jo00349a007.
- László Kürti, Barbara Czakó: Strategic applications of named reactions in organic synthesis: background and detailed mechanisms. Elsevier Academic Press, Amsterdam / Boston 2005, ISBN 0-12-429785-4, S. 402–403.
- S. Müller, B. Liepold, G. J. Roth, H. J. Bestmann: An Improved One-pot Procedure for the Synthesis of Alkynes from Aldehydes. In: Synlett. Band 6, 1996, S. 521–522, doi:10.1055/s-1996-5474.
- Methanolysis of Dimethyl (1-Diazo-2-oxopropyl) Phosphonate: Generation of Dimethyl (Diazomethyl) Phosphonate and Reaction with Carbonyl Compounds. In: Synthetic Communications: An International Journal for Rapid Communication of Synthetic Organic Chemistry. Band 19, Nr. 3–4, 1989, S. 561–564, doi:10.1080/00397918908050700.
- G. J. Roth, B. Liepold, S. G. Müller, H. J. Bestmann: Further Improvements of the Synthesis of Alkynes from Aldehydes. In: Synthesis. Band 1, 2004, S. 59–62, doi:10.1055/s-2003-44346.