Rubidiumpermanganat
Rubidiumpermanganat ist das Rubidiumsalz der im freien Zustand unbekannten Permangansäure, HMnO4. Das Mangan liegt darin in seiner höchsten Oxidationsstufe +VII vor.
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
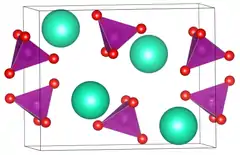 | |||||||||||||
| _ Rb+ _ O2− _ Mn7+ | |||||||||||||
| Kristallsystem |
orthorhombisch | ||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | ||||||||||||
| Gitterparameter |
a = 954,11 pm, b = 573,926 pm, c = 763,63 pm | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Rubidiumpermanganat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | RbMnO4 | ||||||||||||
| Kurzbeschreibung |
violette nadel-/oktaederförmige Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 204,404 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
3,325 g·cm−3[2] | ||||||||||||
| Schmelzpunkt |
295 °C (Zersetzung)[2] | ||||||||||||
| Löslichkeit |
wenig löslich in Wasser (10,6 g·l−1 bei 19 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Herstellung
Rubidiumpermanganat kann aus Kaliumpermanganat und Rubidiumchlorid hergestellt werden.[5][6]
Eigenschaften
Physikalische Eigenschaften
Rubidiumpermanganat ist wenig wasserlöslich, die Löslichkeit nimmt mit steigender Temperatur zu. Bei 7 °C enthält 1 Liter der gesättigten Lösung 6,03 g,[3] bei 19 °C 10,6 g[2] und bei 60 °C 46,8 g.[7] Es kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterparametern a = 954,1 pm, b = 573,9 pm und c = 763,6 pm.[1] In der Elementarzelle befinden sich vier Formeleinheiten. Die Kristalle sind isomorph zu Caesiumpermanganat, Ammoniumpermanganat und Kaliumpermanganat.
Chemische Eigenschaften
Rubidiumpermanganat zersetzt sich analog zum Kaliumpermanganat in zwei Stufen, wobei intermediär Rubidiummanganat(VI) entsteht. Als weitere Zersetzungsprodukte entstehen Mangan(IV)-oxid, Rubidiumoxid und elementarer Sauerstoff.[5] Die Zersetzung findet zwischen 200 und 300 °C statt.[8] Der Massenverlust durch die Sauerstoffentwicklung beträgt 8,0 %.[8]
Verwendung
In der qualitativen Analyse findet Rubidiumpermanganat als Reagens zum Nachweis von Perchlorat-Ionen Verwendung. Es wird intermediär aus Rubidiumnitrat und Kaliumpermanganat hergestellt und fällt mit vorhandenen Perchlorat-Ionen als RbClO4·RbMnO4 - Mischkristall aus.[9]
Einzelnachweise
- R. Hoppe, D. Fischer, J. Schneider: Zur Kenntnis von Oxyden A[MO4]: Über LiMnO4, KMnO4, RbMnO4, CsMnO4 sowie RbIO4 und CsIO4. (– Was heißt eigentlich “Die Kristallstruktur von …”? –). In: Zeitschrift für anorganische und allgemeine Chemie. Band 625, Nr. 7, 1999, S. 1521–3749, doi:10.1002/(SICI)1521-3749(199907)625:7<1135::AID-ZAAC1135>3.0.CO;2-L.
- Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 336 (eingeschränkte Vorschau in der Google-Buchsuche).
- Aterton Seidell: Solubilities of Organic Compounds. Band 1, 1940, S. 1438 (Volltext).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Michael W. Beck, Michael E. Brown: Thermal analysis of antimony/potassium permanganate pyrotechnic compositions. In: Thermochimica Acta. Band 65, Nr. 2-3, 1983, S. 197–212, doi:10.1016/0040-6031(83)80022-7 (PDF (Memento vom 29. Oktober 2013 im Internet Archive)).
- P. J. Herley, E. G. Prout: The Thermal Decomposition of Rubidium Permanganate. In: The Journal of Physical Chemistry. Band 64, Nr. 5, 1960, S. 675–677, doi:10.1021/j100834a503.
- Austin M. Patterson: Solubilities of Permanganates of the Alkali Metals. In: Journal of the American Chemical Society. Band 28, Nr. 12, 1906, S. 1734–1736, doi:10.1021/ja01978a009.
- Z. Gontarz, B. Pisarska: Thermal decomposition stages of potassium, rubidium and caesium permanganates. In: Journal of Thermal Analysis and Calorimetry. Band 6, Nr. 6, September 1990, S. 2113–2117, doi:10.1007/BF01914135.
- E. Gerdes: Qualitative anorganische Analyse. Ein Begleiter für Theorie und Praxis. 2. Auflage. Springer, 2001, ISBN 978-3-540-67875-5, S. 139 (eingeschränkte Vorschau in der Google-Buchsuche).