Caesiumpermanganat
Caesiumpermanganat ist das Caesiumsalz der im freien Zustand unbekannten Permangansäure, HMnO4. Das Mangan liegt darin in seiner höchsten Oxidationsstufe +VII vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
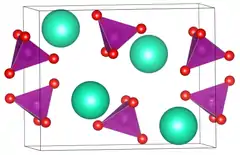 | |||||||||||||||||||
| _ Cs+ _ O2− _ Mn7+ | |||||||||||||||||||
| Kristallsystem |
orthorhombisch | ||||||||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | ||||||||||||||||||
| Gitterparameter |
a = 1006 pm, b = 580,1 pm, c = 794,4 pm | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Caesiumpermanganat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CsMnO4 | ||||||||||||||||||
| Kurzbeschreibung |
violette nadel-/oktaederförmige Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 251,8406 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,60 g·cm−3[1] | ||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (2,3 g·l−1 bei 19 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Physikalische Eigenschaften
Caesiumpermanganat ist wenig wasserlöslich, die Löslichkeit nimmt mit steigender Temperatur zu, bei 1 °C 0,97 g, bei 19 °C 2,3 g und bei 59 °C 12,5 g/l.[2][4] Es kristallisiert im orthorhombischen Kristallsystem[5] in der Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterparametern a = 1006 pm, b = 580,1 pm und c = 794,4 pm.[1] In der Elementarzelle befinden sich vier Formeleinheiten. Die Kristalle sind isomorph zu Rubidiumpermanganat, Ammoniumpermanganat und Kaliumpermanganat.
Chemische Eigenschaften
Caesiumpermanganat zersetzt sich analog zum Kaliumpermanganat in zwei Stufen, wobei intermediär Caesiummanganat(VI) entsteht. Als weitere Zersetzungsprodukte entstehen Mangan(IV)-oxid, Caesiumoxid und elementarer Sauerstoff.[6] Die Zersetzung findet zwischen 200 und 300 °C statt.[7]
bzw. die Gesamtzersetzungsreaktion:
Einzelnachweise
- R. Hoope, D. Fischer, J. Schneider: Zur Kenntnis von Oxyden A[MO4]. Über LiMnO4, KMnO4, RbMnO4, CsMnO4 sowie RbIO4 und CsIO4. (– Was heißt eigentlich “Die Kristallstruktur von …”? –). In: Zeitschrift für anorganische und allgemeine Chemie. Band 625, Nr. 7, 1999, S. 1135–1142, doi:10.1002/(SICI)1521-3749(199907)625:7<1135::AID-ZAAC1135>3.0.CO;2-L.
- Atherton Seidell (Hrsg.): Solubilities of Inorganic and Organic Substances. A Handbook of the Most Reliable Quantitative Solubility Determinations. D. Van Nostrand Company, 1907 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Austin M. Patterson: Solubilities of Permanganates of the Alkali Metals. In: Journal of the American Chemical Society. Band 28, Nr. 12, 1906, S. 1734–1736, doi:10.1021/ja01978a009.
- W. Muthmann: Beiträge zur Volumtheorie der krystallisirten Körper. In: Zeitschrift für Krystallographie und Mineralogie. Band 22, 1894, S. 530 (Web-Archiv).
- Michael W. Beck, Michael E. Brown: Thermal Analysis of Antimony/Potassium Permanganate Pyrotechnic Compositions. In: Thermochimica Acta. Band 65, Nr. 2–3, 25. Juli 1983, S. 197–212, doi:10.1016/0040-6031(83)80022-7.
- Z. Gontarz, B. Pisarska: Thermal decomposition stages of potassium, rubidium and caesium permanganates. In: Journal of Thermal Analysis and Calorimetry. Band 36, Nr. 6, September 1990, S. 2113–2117, doi:10.1007/BF01914135.