Rotigotin
Rotigotin (Handelsname Neupro; Pharmazeutischer Unternehmer: UCB) ist ein Arzneistoff aus der Gruppe der non-ergolinen Dopaminagonisten, der in der Behandlung der Parkinson-Erkrankung sowie des idiopathischen Restless-Legs-Syndroms eingesetzt wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
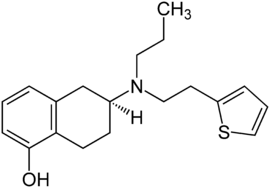 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Rotigotin | |||||||||||||||||||||
| Andere Namen |
(–)-(S)-6-[Propyl(2-thiophen-2-ylethyl)amino]-5,6,7,8-tetrahydronaphthalen-1-ol | |||||||||||||||||||||
| Summenformel | C19H25NOS | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N04BC09 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 315,47 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Rotigotin wird zur symptomatischen Behandlung der Parkinson-Erkrankung im Frühstadium alleine und in späteren Stadien der Erkrankung in Kombination mit Levodopa eingesetzt. Außerdem kann es zur Behandlung des schweren bis mittelschweren idiopathischen Restless-Legs-Syndroms angewendet werden. Rotigotin wird in Form eines transdermalen Pflasters, aus welchem der Wirkstoff kontinuierlich freigesetzt wird, einmal täglich angewendet.
Wirksamkeit und Verträglichkeit von Rotigotin sind in einer Reihe von klinischen Studien gezeigt worden.[2][3] Motorische Leistungen und Aktivitäten des täglichen Lebens der Parkinson-Patienten verbesserten sich signifikant unter einer Behandlung mit Rotigotin.
Dosierung, Art und Dauer der Anwendung
Durch die transdermale Applikation wird der Wirkstoff Rotigotin kontinuierlich über 24 Stunden zugeführt. Durch die resultierenden stabil bleibenden Plasmaspiegel werden die Dopaminrezeptoren im Gehirn kontinuierlich stimuliert, wodurch die Beweglichkeit der Patienten verbessert und das Auftreten von Dyskinesien (Gehstörungen) reduziert wird. Die Wirkung des Pflasters ist unabhängig von Mahlzeiten, Gastroparesen oder Resorptionsstörungen. Es sind Dosierungen von 1 mg bis maximal 16 mg pro 24 Stunden möglich. Falls die Anwendung von Rotigotin abgebrochen werden muss, ist die Behandlung ausschleichend zu beenden.
Gegenanzeigen
Rotigotin ist nicht angezeigt bei bekannter Überempfindlichkeit gegenüber Rotigotin.
Unerwünschte Wirkungen
Unter einer Behandlung mit Rotigotin treten typische dopaminerge Nebenwirkungen wie Übelkeit, Erbrechen, Schwindel oder Schläfrigkeit auf. Zwischen einem Promille und einem Prozent der mit Rotigotin behandelten Patienten litten unter einem chronischen Husten.
Bei gleichzeitiger Einnahme mit Dopaminantagonisten (z. B. Neuroleptika) kann es zur Wirkungsverminderung kommen. Bei gleichzeitiger Anwendung von sedierenden Arzneimitteln (z. B. Benzodiazepine oder Antidepressiva) bzw. Alkohol besteht die Gefahr einer gegenseitigen Wirkungsverstärkung.
Schwangerschaft und Stillzeit
Es liegen keine klinischen Daten über die Sicherheit von Rotigotin während einer Schwangerschaft vor. Aufgrund der prolaktinhemmenden Wirkung von Dopaminagonisten ist zu erwarten, dass die Milchbildung unterdrückt wird. Untersuchungen an der Ratte haben ergeben, dass Rotigotin und dessen Metaboliten in die Muttermilch übergehen. Da keine entsprechenden Daten für den Menschen vorliegen, soll Rotigotin während der Stillzeit nicht angewendet werden oder das Stillen beendet werden.
Pharmakologische Eigenschaften
Wirkungsmechanismus
Rotigotin ist ein Agonist an D3/D2/D1-Rezeptoren.
Pharmakokinetik
Der Wirkstoff wird nach Aufbringen des transdermalen Pflasters fortlaufend freigesetzt. Die steady-state-Konzentration ist nach ein bis zwei Tagen erreicht. Rotigotin wird zu ungefähr 92 % an Plasmaproteine gebunden, das scheinbare Verteilungsvolumen beträgt ca. 84 Liter pro Kilogramm. Die Bioverfügbarkeit liegt bei transdermaler Applikation bei etwa 37 %. Sie schwankt je nach Anwendungsort, was aber die therapeutische Wirksamkeit nicht beeinträchtigen soll. Durch die transdermale Zuführung von Rotigotin werden First-Pass-Effekt, Auswirkungen durch Nahrungsmittel und gastrointestinale Erkrankungen vermieden.
Rotigotin wird zum Teil durch N-Dealkylierung verstoffwechselt, welche durch verschiedene Cytochrom P450-Isoforme katalysiert wird, was In-vitro-Ergebnisse nahelegen. Die Hauptmetaboliten sind Sulfate und Glucuronidkonjugate, die durch direkte und sekundäre Konjugation des Rotigotin entstehen, sowie biologisch inaktive N-Desalkylmetaboliten.
Toxikologie
In klinischen Studien wurden keine Fälle von Überdosierung berichtet. Bei den wahrscheinlichsten unerwünschten Ereignissen handelt es sich um solche, die mit dem pharmakodynamischen Profil eines Dopaminagonisten in Zusammenhang stehen, darunter Übelkeit, Erbrechen, Hypotonie, unwillkürliche Bewegungen, Halluzinationen, Verwirrtheit, Krampfanfälle (Konvulsionen) und sonstige Zeichen einer zentralen dopaminergen Stimulation. Es ist kein Antidot bekannt für die Behandlung einer Überdosierung von Dopaminagonisten.
Handelsnamen und Darreichungsformen
Rotigotin wird ausschließlich transdermal mittels Pflaster verabreicht, die Rotigotindosis wird über die Pflastergröße reguliert. Es sind Pflaster mit 1, 2, 3, 4, 6 oder 8 mg pro 24 Stunden verfügbar.
Entwicklungsgeschichte
Rotigotin wurde in den 1980er Jahren an der Universität Groningen synthetisiert und 1985 erstmals als N-0437 beschrieben.[4] Die Entwicklungs- und Vermarktungsrechte wurden 1998/99 von der US-amerikanischen Firma Aderis an die deutsche Firma Schwarz Pharma übertragen, die 2006 an die belgische UCB S.A. überging.
Das Arzneimittel wurde im Februar 2006 in der EU für die Behandlung des Frühstadiums der Parkinson-Erkrankung zugelassen. Im Januar 2007 folgte die EU-Zulassung für die späteren Stadien der Erkrankung und im Mai 2007 die US-Zulassung für das Frühstadium.
Aufgrund technischer Probleme bei der Herstellung des Pflasters erfolgte im März 2008 ein Rückruf vom US-amerikanischen Markt,[5] während die Versorgung der Patienten in der EU mittels Kühlkette erfolgte.[6][7]
Im August 2008 erfolgte die Zulassung durch die Europäische Kommission für die symptomatische Behandlung von mittelschwerem bis schwerem idiopathischem Restless Legs Syndrom bei Erwachsenen und seit Juni 2009 ist Neupro in dieser Indikation verschreibbar.
Anfang April 2012 erfolgte die erneute Zulassung seitens der FDA für den amerikanischen Markt.
Weblinks
- Informationen zu Neupro auf der Website der Europäischen Arzneimittelagentur
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von (6S)-6-[propyl(2-thiophen-2-ylethyl)amino]-5,6,7,8-tetrahydronaphthalen-1-ol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juli 2020.
- Parkinson Study Group: A Controlled Trial of Rotigotine Monotherapy in Early Parkinson’s Disease. In: Arch Neurol, 2003, 60, S. 1721–1728. PMID 14676046
- RL Watts, J Jankovic, C Waters et al.: Randomized, blind, controlled trial of transdermal rotigotine in early Parkinson disease. In: Neurology, 2007, 68, S. 272–276, PMID 17202432.
- AS Horn, P Tepper, J Van der Weide et al.: Synthesis and radioreceptor binding activity of N-0437, a new, extremely potent and selective D2 dopamine receptor agonist. In: Pharm Weekbl Sci, 1985, 7, S. 208–211, PMID 2933633.
- UCB advises US-physicians to down-titrate patients on Neupro® in view of out-of-stock situation in the US. (PDF; 44 kB) Presseerklärung UCB S.A., 20. März 2008; abgerufen am 2. August 2008.
- UCB to implement full cold-chain for Neupro® (PDF; 39 kB) Presseerklärung UCB S.A., 4. Juni 2008; abgerufen am 2. August 2008.
- Rote-Hand-Brief zu Neupro® transdermales Pflaster: Hinweise zur Lagerung. BfArM, 12. Juni 2008, abgerufen am 29. April 2017.