Richelia
Richelia ist eine Gattung stickstofffixierender Cyanobakterien, die fadenförmige Kolonien (Zellketten) mit Heterocysten bilden. Die Gattung enthält die Typusart Richelia intracellularis. Sie kommen sowohl als freilebende Organismen als auch als Symbionten von möglicherweise bis zu 13 verschiedenen Kieselalgenarten vor, die über alle Weltmeere verteilt sind. Als Symbiont kann sich Richelia als Epibiont („epiphytisch“) und als Endosymbiont im periplasmatischen Raum zwischen der Zellmembran und der Zellwand der Kieselalgen ansiedeln.
| Richelia | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Zelle der Kielselalge Guinardia cylindrus[1] mit mehreren Filamenten von Richelia im Innern der Frusteln. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Richelia | ||||||||||||
| J. Schmidt |
Morphologie
Richelia bildet Kolonien in Form haarähnlichen Strukturen, die wegen ähnlicher Morphologie wie bei einer Vielzahl von Landpflanzen ebenfalls Trichome genannt werden. Das Vorkommen von Richelia bzw. Richelia-Trichomen als freilebende Organismen in der Meeresumwelt ist eher selten. Die Position von Richelia innerhalb ihrer verschiedenen Kieselalgen-Symbionten ist nicht vollständig geklärt, obwohl allgemein angenommen wird, dass sie sich im periplasmatischen Raum der Kieselalge zwischen dem Plasmalemma und den Frusteln befinden.[3][4][5][6] Die Trichome von Richelia bestehen aus zwei Zelltypen: den Heterozysten und den restlichen etwa 3 oder 4 „vegetativen“ Zellen.[4] Die Heterozysten sind endständige Einzelzellen, in denen (neben der sauerstofflosen Photosynthese I) die Stickstofffixierung stattfindet. In den restlichen vegetativen Zellen findet auch die Photosynthese II statt, bei der Sauerstoff entsteht. Die Heterozyste teilt sich nicht, während die vegetativen Zellen dies tun (vegetative Vermehrung).[4] Die Anzahl der Trichome, die Richelia in jedem Kieselalgenwirt haben, variiert.[7] Die Trichome dienen der Stickstofffixierung und dem Nährstoffaustausch mit den Wirtskieselalgen.[4] Es gibt aber auch Richelia, die nur aus einer Heterocyste bestehen.[7] Die Heterozyste ist durch eine dicke Glykolipidschicht gekennzeichnet, die die Fähigkeit des Sauerstoffs, die Stickstofffixierung zu stören, minimiert. Dies ist wichtig, da Sauerstoff an die Nitrogenase binden und auf diese Weise die Stickstofffixierung der hemmen kann. Prozesse, die eine Anwesenheit von Sauerstoff bedingen, und solche, die Nitrogenase benötigen müssen daher grundsätzlich räumlich (oder zeitlich) getrennt voneinander stattfinden.[4] Richelia bleiben auch innerhalb ihrer Wirtskieselalgen photosynthetisch aktiv, ein Verhalten, das für ähnliche Symbionten eher ungewöhnlich ist.[4]
Symbiose
Stickstofffixierung und Symbiose
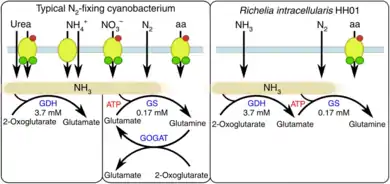
Die Stickstofffixierung ist ein wichtiger biologischer Prozess in marinen Ökosystemen. In vielen Regionen der Weltmeere begrenzt die Verfügbarkeit von anorganischem Stickstoff wie Nitrat und Ammonium die Geschwindigkeit der Photosynthese (Primärproduktion). Daher können Organismen einen evolutionären Vorteil haben, wenn sie symbiotische Beziehungen mit anderen Organismen (oft Cyanobakterien), eingehen, um Stickstoff zu fixieren. Bei vielen Cyanobakterien erfolgt die Stickstofffixierung in spezialisierten Zellen, den so genannten Heterocysten. Cyanobakterien der Gattung Richelia sind ein Beispiel für Cyanobakterien, die in der Lage sind, Stickstoffgas (N2) in organischen Stickstoffverbindungen zu fixieren.[8] Wenn die Cyanobakterien eine symbiotische Beziehung mit Kieselalgen eingehen, dann kann der organische Stickstoff auf diese übertragen werden.[8] Ein solcher Stickstofftransfer wurde mehrfach beobachtet. Diese Beziehung hat Vorteile sowohl für die Richelia-Zellen, die sich innerhalb der Kieselalge befinden, als auch für die Kieselalge selbst. So wird beispielsweise das Wachstum der Cyanobakterien innerhalb der Kieselalge gefördert, wodurch durch die Atmung Kohlendioxid freigesetzt wird, das von der Kieselalge für die Photosynthese genutzt werden kann. Die Kieselalge profitiert mit einem verstärkten Wachstum infolge des von den Cyanobakterien gebundenen Stickstoffs. Eine derartige Symbiose (en. diatom-diazotroph association, DDA) kann es Kieselalgen ermöglichen, unter stickstofflimitierenden Bedingungen zu überleben.[3][9]
Wirtsspezifität
Die Wirtsspezifität der Richelia-Arten bzw. -Stämme und ihre Platzierung innerhalb eines Wirts werden mit der Evolution des Symbiontengenoms (bzw. Koevolution von Bakterium und Kieselalgenwirt) erklärt. Selbst bei taxonomisch und morphologisch verwandten Organismen unterscheiden sich die Vorlieben für Kieselalgenwirte und die Platzierung innerhalb eines Wirts.[10] Oft hängt es davon ab, in welchem Wirt sich ein Symbiont typischerweise aufhält. Bei der Symbiose von Hemiaulus und Richelia zum Beispiel lebt Richelia im Inneren der Kieselalgen-Frusteln (Schalen) von Hemiaulus. Richelia fehlen die wichtigsten Enzyme und Transporter des Stickstoffmetabolismus, wie z. B. Ammoniumtransporter, Nitrat- und Nitritreduktasen sowie die Glutamatsynthase. Diese Gattung hat auch ein reduziertes Genom, entsprechend Annahme der Genomverkleinerung (englisch Genomic streamlining: Reduzierung nicht-kodierender DNA-Abschnitte und nicht-essentieller Gene bietet Prokaryoten einen evolutionären Vorteil). Hemiaulus verfügt über Gene, die für all diese Enzyme und Transporter kodieren, während ihm die Stickstofffixierungsgene von Richelia fehlen. Die Symbiose ermöglicht es dem Wirt, seinen Symbionten mit diesem fehlenden Substanzen zu ergänzen und umgekehrt (Mutualismus). Als Resultat der gemeinsamen Genomevolution von Wirt und Symbiont entsteht so eine Wirtsspezifität der Symbionten.[10]
Tag-und-Nacht-Rhythmus der Genexpression
Tag-Nacht-Zyklen in der Genexpression scheinen eine wichtige Rolle bei der Koordinierung des Ressourcenaustauschs und der Zellteilung zwischen diazotrophen Symbionten und ihrem Kieselalgenwirt zu spielen. Die Gene für Photosynthese, Stickstofffixierung und Ressourcenerwerb zeigen in Richelia in ihrem Expressionsmuster Tag-Nacht-Schwankungen. Genauer scheinen die Expression von Genen für die Stickstoffaufnahme, den Stoffwechsel und den Kohlenstofftransport in den Kieselalgenwirten mit der Expression von Genen für die Stickstofffixierung in Richelia synchronisiert zu sein, was auf einen koordinierten Austausch von Stickstoff und Kohlenstoff schließen lässt. Man geht davon aus, dass die Physiologie der Symbionten und der Wirtszellen koordiniert ist und stark voneinander abhängt, insbesondere in Bezug auf die Tageszeit.[11]
Assoziierte Spezies
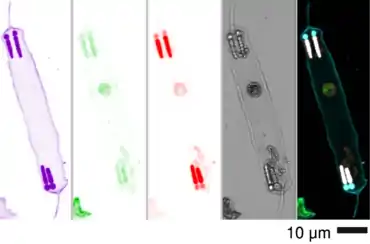

Zwar wurden in Studien bis zu 13 Arten von Richelia beschrieben, doch ist umstritten, wie viele dieser Charakterisierungen zutreffend waren und wirklich neue Arten von Richelia identifizieren.[12]
Die an besten belegten symbiotischen Beziehungen zwischen Diatomeen (Kieselalgen) und Richelia sind die folgenden:
- Rhizosolenia — Richelia lebt im Inneren der Kieselalgenzelle außerhalb der Plasmamembran im periplasmatischen Raum.[13][14][15][16][9]
- Hemiaulus – Richelia lebt in dieser Symbiose ebenfalls innerhalb der Kieselalgenzelle, der genaue Ort ist derzeit (Stand 2020) nicht bekannt.[14] Die Hemiaulus-Richelia-Symbiose ist häufig zusätzlich mit Cyanobakterien der Gattung Trichodesmium vergesellschaftet, insbesondere in Übergangsgewässern.[17][16][9]
- Chaetoceros – Diese Symbiose scheint jedoch selten zu sein.[18][9]
- Guinardia – Eine Symbiose nachweislich in den Frusteln von G. cylindrus aus der Danziger Bucht und der umgebenden Ostsee.[1][2]
Arten und Stämme
Der nachfolgenden Systematik liegen die folgendfen Quellen zugrunde:
- LPSN (List of Prokaryotic names with Standing in Nomenclature)[19]
- WoRMS (World Register of Marine Species)[20]
- AlgaeBase (SITE)[21]
- NCBI (National Center for Biotechnology Information)[22]
Stand: 5. September 2021
Gattung Richelia J. Schmidt, 1902
- Spezies Richelia intracellularis J.A.Schmidt, 1901/1902 — Typus (LPSN, WoRMS, AlgaeBase, NCBI), Typlokalitäten Rotes Meer und Golf von Thailand.[23][24]
- Stamm Richelia intracellularis HH01 (NCBI)
- Stamm Richelia intracellularis HM01 (NCBI)
- Stamm Richelia intracellularis RC01 (NCBI)
- Stamm Richelia intracellularis UBA3481 (NCBI)
- Stamm Richelia intracellularis UBA7409 (NCBI)
- Stamm Richelia cyanobiont of Rhizosolenia sp. (NCBI)
- Stamm Richelia sinica FACHB-800 (NCBI)
Mutmaßliche/mögliche weitere Spezies mit vorläufigen Bezeichnungen:
- Spezies Richelia sp. AO9565
- Spezies Richelia sp. CSU_2_1
- Spezies Richelia sp. PO9804-4
- Spezies Richelia sp. PO9804-5
- Spezies Richelia sp. PO9811-3
- Spezies Richelia sp. PO9814-5
- Spezies Richelia sp. PO9847-2
- Spezies Richelia sp. PO9847-3
- Spezies Richelia sp. PO9847-9
- Spezies Richelia sp. RM1_1_1
- Spezies Richelia sp. RM2_1_2
- Spezies Richelia sp. SC01
- Spezies Richelia sp. SL_2_1
- Spezies Richelia sp. SM1_7_0
- Spezies Richelia sp. SM2_1_7
- Spezies Richelia sp. UBA3308
- Spezies Richelia sp. UBA3957
- Spezies Richelia sp. UBA3958
Richelia siamensis (Antarikanonda) Hindák, 2000, ehemals Anabaena siamensis Antarikanonda, 1985 wird aktuell der Gattung Cylindrospermum zugeordnet und gilt als Synonym für Cylindrospermum siamense (Antarikanonda) J.R.Johansen & M.Bohunická, 2014 (AlgaeBase)
Die Taxonomie der Gattung wird noch diskutiert und es ist beispielsweise gut möglich, dass etliche der vorgeschlagenen Spezies sich entweder als Stämme bereits vorhandener Spezies erweisen werden, oder als Stämme einer gemeinsamen neuen Spezies zusammengefasst werden. Weitere Forschung ist nötig.
Etymologie
Die Gattung Richelia wurde benannt zu Ehren des dänischen Admirals Andreas de Richelieu ([da]), als Dank für seine Unterstützung der Siam-Expedition des Erstautors 1899–1900 (dänisch „Jeg benævner denne interessante Alge i Erindring af vor Landsmand Admiral A. de Richelieu, som paa saa mange Maader har støttet vor Ekspedition til Siam.“).[24] Das Namensepitheton intracellularis der Typusspezies ist lateinisch für (faktisch vielleicht nicht ganz zutreffend) ‚intrazellulär‘.
Lebenszyklus
In Diatomeen-Wirten
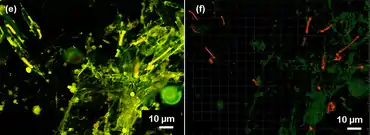
Richelia-Organismen sind am häufigsten in Wirtskieselalgen zu finden und am besten zu verstanden. Während des größten Teils ihres Lebenszyklus innerhalb von Kieselalgen bleibt die Ausrichtung der Richelia-Zellen unverändert,[27] wobei die terminalen Heterocyste auf die nächstgelegene (nachbarliche) Kieselalgenschale ausgerichtet ist.[5][27] Diese Ausrichtung ändert sich nur bei Abtrennung und Wanderung der Richelia-Trichome.[27] Es wird angenommen, dass diese Abtrennung und Wanderung synchron mit dem Wachstum und der Teilung der Wirtskieselalge erfolgt (d. h. wenn diese Tochterzellen produziert), um die neuen Tochterzellen mit Symbionten zu versorgen.[5] Zwar wurde R. intracellularis in der Erstbeschreibung als obligater Endosymbiont in den Frusteln von mariner Kieselalgen charakterisiert.[23][24] In toten oder absterbenden Kieselalgen haben einige Richelia-Filamente vergrößerte und abgerundete vegetative Zellen, einige beginnen zu zerfallen und sterben mit ihrem Wirt, aber einige treten aus einer Öffnung in der Kieselalgenschale (Frustel) aus[15][5] und werden vermutlich zu freilebenden Richelia.[5]
Freilebend
Obwohl Richelia-Organismen freilebend in der Meeresumwelt vorkommen können, werden sie in dieser Umgebung nur selten beobachtet. Außerdem ist nicht bekannt, wie Kieselalgen ohne Symbionten wieder von freilebenden Richelia-Organismen besiedelt werden; es werden mehrere Mechanismen vermutet, darunter das direkte Eindringen von Richelia-Zellen in symbiontenfreie Kieselalgen. Nach einer weiteren Hypothese könnten Richelia-Zellen mit Auxosporen der Kieselalgen verbunden sein oder während der sexuellen Fortpflanzung in die Kieselalgenzellen eindringen. Richelia-Zellen können sich aber offenbar auch während der vegetativen Zellvergrößerung in Kieselalgen ansiedeln.[5]
Verbreitung
Cyanobakterien der Gattung Richelia werden vor allem in symbiotischer Verbindung mit Kieselalgen in den stickstoffarmen Regionen der Ozeane gefunden.[4] Ähnlich wie bei anderen diazotrophe Organismen (insbesondere Symbionten) ist Richelia in produktiven äquatorialen Regionen mit ausreichend Nährstoffangebot in geringer Menge vorhanden, kommen dagegen in großer Menge in unproduktiven subtropischen Gebieten mit niedriger Nitratkonzentrationen vor, die das Wachstum endosymbiontenfreier Kieselalgen begrenzen. Dieses Verbreitungsmuster wird auf die symbiotische Beziehung zurückgeführt, die Richelia mit verschiedenen Kieselalgenarten eingeht, indem sie diese mit organisch gebundenem Stickstoff versorgt, so dass die Wachstumslimitierung umgangen wird.[28]
Quantitative Analysen der Verbreitung von Richelia und ihrer Kieselalgenwirte sind ein aufstrebendes Forschungsgebiet.[28] Um korrekte Ergebnisse zu erzielen, ist es nötig, die Wirte und die dazugehörigen diazotrophen Symbionten korrekt zu identifizieren, sowie einen sicheren Nachweis der symbiotischen Beziehungen zu erbringen, was früher nicht immer in ausreichender Weise erbracht werden konnte.[29]
Weltmeere allgemein
Richelia kommt im gesamten Pazifik, im Atlantik, im Mittelmeer und im Ästuar um das Mündungsgebiet des Amazonas (englisch Amazon River plume) vor.[28][30] Dabei ist diese Gattung ähnlich verbreitet wie andere Diazotrophe, darunter Cyanobakterien der Gattung Trichodesmium, Candidatus Atelocyanobacterium thalassa (früher bekannt als UCYN-A) und Crocosphaera watsonii (UCYN-B), die in weiten Teilen der tropischen Ozeane in großer Zahl vorkommen. Dabei variiert die relative Häufigkeit der verschiedenen Kieselalgen-Taxa zueinander. Die absolute Häufigkeit von Richelia-Zellen variiert je nach den Umweltbedingungen in den verschiedenen Regionen. Im Vergleich zu anderen diazotrophen Organismen ist die Häufigkeit von Richelia in größeren Tiefen geringer.[28] Warme, silikatreiche Bedingungen, wie sie im Amazonas-Mündungsgebiet anzutreffen sind, ermöglichen hohe Richelia-Wachstumsraten. Die Häufigkeit von Richelia nimmt ab, wenn der anorganische Stickstoffgehalt steigt, da sie bei hohen Nitratkonzentrationen einen Wettbewerbsnachteil haben. Im Gegensatz zu anderen Diazotrophen nimmt die Häufigkeit von Richelia jedoch nicht ab, wenn der Phosphatgehalt hoch ist. Die Häufigkeit von Richelia-Zellen hängt jedoch auch von der Verfügbarkeit von Eisen ab, da das zur Fixierung von Distickstoff (N2) benötigte Enzym Nitrogenase Eisen benötigt.[28] Weitere Faktoren, die die Häufigkeit von Richelia und anderen Diazotrophen bestimmen, finden sich bei Wang et al (2019).[31]
Mittelmeer
Richelia ist ein Endosymbiont von Kieselalgen wie z. B. der Gattungen Rhizosolenia und Hemiaulus. Es wurde festgestellt, dass Richelia stark mit dem Vorkommen von Hemiaulus-Spezies korreliert ist, aber nur ab und zu mit dem Vorhandensein von Rhizosolenia zusammenfällt. Es wird vermutet, dass das symbiotische Paar Hemiaulus/Richelia einen evolutionären Vorteil gegenüber anderen Wirtsoptionen für Richelia hat.[30][7] Die höchsten Richelia-Dichten, die 2006 im östlichen Mittelmeer beprobt wurden, liegen bei 50 Heterozysten/Liter im Juni und Oktober in den Küstenregionen und bei ebenfalls 50 Heterozysten/Liter im Juni und November in den küstenfernen Regionen.[30] Diese Spitzenwerte treten während einer Vertiefung der Mischungsschicht in jeder Region auf.[30][7] Aufgrund des starken Nährstoffaustauschs mit dem Atlantik durch die Straße von Gibraltar Die Strömungsverhältnisse im Mittelmeer bewirken einen starken Nährstofftransports durch die Straße von Gibraltar in den Nordatlantik. Daher herrschen im östlichen Mittelmeer extrem oligotrophe (nährstoffarme) Bedingungen. Hier bietet Richelia ihren Kieselalgenwirten wichtige Stickstofffixierungsmöglichkeiten. Frei lebende Richelia kommen im östlichen Mittelmeer auf der Grundlage der derzeit (Stand 2008) verfügbaren Ergebnisse von Probenahmeexperimenten nicht vor. In den Wassersäulen des östlichen Mittelmeers ist Richelia der wichtigste tagaktive Organismus mit einer Expression des nifH-Gens (für eine der Untereinheiten der Nitrogenase). Ein Fall von allopatrischer Speziation (Artbildung) wird zwischen küstennahen und pelagischen Wassersäulen im östlichen Mittelmeer beobachtet: Diese beiden Regionen weisen unterschiedliche Kladen von nifH-exprimierenden Richelia-Organismen auf, was vermutlich darauf zurückzuführen ist, dass die beiden Regionen durch eine hydrologische Barriere voneinander getrennt sind. Verursacht wird diese Barriere vermutlich durch die Neigung des Kontinentalschelfs in diesem Bereich.[30]
Westlicher Pazifik
Richelia-Organismen wurden als Epibionten („Epiphyten“) auf Chaetoceros compressus und auf Rhizosolenia clevei im westlichen Pazifik gefunden. Es wird vermutet, dass sich die Richelia-Filamente von Rhizosolenia clevei ablösen und anschließend zu Symbionten von Chaetoceros compressus werden können. Dies wird vermutet, seit die Symbiose von Richelia auf Chaetoceros compressus gefunden wurde, nachdem bereits vorher die Symbiose von Richelia auf Rhizosolenia clevei bekannt geworden war.[29]
Außer Richelia intracellularis ist auch Calothrix rhizosoleniae ein weit verbreitetes heterocystisches stickstofffixierendes Cyanobakterium in nitratbegrenzten tropischen Ozeanen. Zwar leben die meisten von ihnen in Symbiose mit Kieselalgenwirten, aber es gibt jeweils auch freilebende Vorkommen. Die Untersuchung der Populationsdichte dieser beiden Arten im Nordpazifik, insbesondere im Südchinesischen Meer und Kuroshio-Strom) zwischen 2001 und 2014 zeigte, dass ca. 87 % der freilebenden Filamente von Calothrix stammten und knapp 13 % von Richelia (wobei letztere möglicherweise doch mit Rhizosolenia assoziiert waren.[32][33]
Kuroshio-Strom
Die Verbreitung von Richelia im Kuroshio-Strom variiert je nach Strömungsabschnitt und Jahreszeit. Die physikalischen und hydrografischen Bedingungen im Strom variieren das ganze Jahr über und führen zu Veränderungen beim Wachstum von Bakterien- und Kieselalgenkolonien. Die Bedingungen im Mai beschränken das Wachstum auf einen engeren Bereich der Strömung als im Juli. Die Region weist sowohl im Frühjahr als auch im Sommer niedrige Nitratkonzentrationen auf, wobei der Juli die geringsten Nitratwerte im Oberflächenwasser zeigt. Die Anzahl der Richelia-Fäden pro Kolonie von Chaetoceros compressus liegt von Mai und November zwischen 4 und 9 und erreicht im Juli ein Maximum. Die maximale Abundanz der Symbiose von Richelia und Chaetoceros compressus tritt im Juli auf, mit 10 Kolonien/Liter. Das Maximum der Symbiose von Richelia und Rhizosolenia clevei liegt ebenfalls im Juli bei 30 Kolonien/Liter.[29]
Sulusee
Eine Symbiose zwischen Richelia und Chaetoceros compressus wurde auch in der südlichen Sulusee beobachtet. Dies ist auf die sehr niedrigen (Nachweisgrenze) Stickstoffkonzentrationen im Oberflächenwasser zurückzuführen, die zu stickstofflimitierenden Bedingungen führen.[29]
Indischer Ocean
Richelia-Filamente wurden als Epibionten („Epiphyten“) auf Chaetoceros compressus auch im Indischen Ozean gefunden.[29]
Westlicher tropischer Atlantik
Stickstofffixierung und Cyanobakterien-Kieselalgen-Symbiosen kommen in der Süßwasserschicht des Amazonas-Mündungsgebiets vor, da die Nitratwerte dort an der Oberfläche niedrig sind. In diesen Bereichen findet man Richelia in Symbiose mit Rhizosolenia clevei und Hemiaulus-Arten. Am häufigsten findet man in dieser Region sowohl in der Tiefe als auch an der Oberfläche die Richelia-Symbiose mit Hemiaulus hauckii an. Dabei ist die Häufigkeit der Symbiose zwischen Richelia und H. hauckii weiter nordwestlich des Amazonasausflusses höher als im übrigen Gebiet. Es besteht eine positive Korrelation zwischen dem Salzgehalt und der Häufigkeit der Richelia-Symbiosen.[29]
Weblinks
- Patricia Sánchez-Baracaldo: Origin of marine planktonic cyanobacteria, in: Nature SciRep, Band 5, Nr. 17418, 1. Dezember 2015, doi:10.1038/srep17418, PDF, dazu:
- Patricia Sánchez-Baracaldo: Origin of marine planktonic cyanobacteria, Sánchez-Baracaldo Lab
Einzelnachweise
- AlgaeBase: Guinardia cylindrus (Cleve) Hasle 1996
- Alexandra Kraberg: Guinardia cylindrus (Cleve) Hasle, 1996, NOSOAT Floating Summer School, Forschungsschiff Polarstern, 14. November 2015
- R. A. Foster, M. M. Kuypers, T. Vagner, R. W. Paerl, N. Musat, J. P. Zehr: Nitrogen fixation and transfer in open ocean diatom-cyanobacterial symbioses. In: The ISME Journal. 5, Nr. 9, September 2011, S. 1484–1493. doi:10.1038/ismej.2011.26. PMID 21451586. PMC 3160684 (freier Volltext).
- K. Inomura, C. L. Follett, T. Masuda, M. Eichner, O. Prášil, C. Deutsch: Carbon Transfer from the Host Diatom Enables Fast Growth and High Rate of N2 Fixation by Symbiotic Heterocystous Cyanobacteria. In: Plants. 9, Nr. 2, Februar 2020, S. 192. doi:10.3390/plants9020192. PMID 32033207. PMC 7076409 (freier Volltext).
- Tracy A. Villareal: Division cycles in the nitrogen-fixing Rhizosolenia (Bacillariophyceae)-Richelia (Nostocaceae) symbiosis. In: British Phycological Journal. 24, Nr. 4, Dezember 1989, S. 357–365. doi:10.1080/00071618900650371.
- Andrea Caputo A, Johan A. A. Nylander, Rachel A. Foster: The genetic diversity and evolution of diatom-diazotroph associations highlights traits favoring symbiont integration. In: FEMS Microbiology Letters. 366, Nr. 2, Januar 2019. doi:10.1093/femsle/fny297. PMID 30629176. PMC 6341774 (freier Volltext).
- R. A. Foster, A. Subramaniam, C. Mahaffey, E. J. Carpenter, D. G. Capone, J. P. Zehr: Influence of the Amazon River plume on distributions of free-living and symbiotic cyanobacteria in the western tropical north Atlantic Ocean. In: Limnology and Oceanography. 52, Nr. 2, März 2007, S. 517–532. bibcode:2007LimOc..52..517F. doi:10.4319/lo.2007.52.2.0517.
- JSTOR 26628504
- Andrea Caputo: Genomic and morphological diversity of marineplanktonic diatom-diazotroph associations — a continuum of integration and diversification through geologicaltime, Dissertation an der Universität Stockholm, Department of Ecology, Environment and PlantSciences, 22. Februar 2019
- J. A. Hilton, R. A. Foster, H. J. Tripp, B. J. Carter, J. P. Zehr, T. A. Villareal: Genomic deletions disrupt nitrogen metabolism pathways of a cyanobacterial diatom symbiont. In: Nature Communications. 4, Nr. 1, 23. April 2013, S. 1767. bibcode:2013NatCo...4.1767H. doi:10.1038/ncomms2748. PMID 23612308. PMC 3667715 (freier Volltext).
- M. J. Harke, K. R. Frischkorn, S. T. Haley, F. O. Aylward, J. P. Zehr, S. T. Dyhrman: Periodic and coordinated gene expression between a diazotroph and its diatom host. In: The ISME Journal. 13, Nr. 1, Januar 2019, S. 118–131. doi:10.1038/s41396-018-0262-2. PMID 30116042. PMC 6299110 (freier Volltext).
- R. A. Foster, G. D. O'Mullan; D. G. Capone, D. A. Bronk, M. R. Mulholland, E. J. Carpenter (Hrsg.): Chapter 27 - Nitrogen-Fixing and Nitrifying Symbioses in the Marine Environment. In: Nitrogen in the Marine Environment (en), Second. Auflage 1. Januar 2008, ISBN 978-0-12-372522-6, S. 1197–1218 publisher=Academic Press (San Diego), doi:10.1016/b978-0-12-372522-6.00027-x.
- Tracy A. Villareal; E. J. Carpenter, D. G. Capone, J. G. Rueter (Hrsg.): Marine Nitrogen-Fixing Diatom-Cyanobacteria Symbioses. In: Marine Pelagic Cyanobacteria: Trichodesmium and other Diazotrophs (en) (= NATO ASI Series). Springer Netherlands (Dordrecht), 1992, ISBN 978-94-015-7977-3, S. 163–175, doi:10.1007/978-94-015-7977-3_10.
- Amy E. Pyle, Allison M. Johnson, Tracy A. Villareal: Isolation, growth, and nitrogen fixation rates of the Hemiaulus-Richelia (diatom-cyanobacterium) symbiosis in culture. In: PeerJ. 8, 8. Oktober 2020, S. e10115. doi:10.7717/peerj.10115. PMID 33083143. PMC 7548074 (freier Volltext).
- Dina Spungin, Natalia Belkin, Rachel A. Foster, Marcus Stenegren, Andrea Caputo, Mireille Pujo-Pay, Nathalie Leblond, Cécile Dupouy, Sophie Bonnet, Ilana Berman-Frank: Programmed cell death in diazotrophs and the fate of organic matter in the western tropical South Pacific Ocean during the OUTPACE cruise, in: Biogeosciences, Band 15, S. 3893–3908, 28. Juni 2018, doi:10.5194/bg-15-3893-2018
- C. C. Manjumol, C. Linoy Libini, K. A. Albert Idu, K. S. Mohamed, V. Kripa: Occurrence of Diatom – Diazotrophic association in the coastal surface waters of south Andaman, India, in: Symbiosis, Band 76, 4. Juni 2018, S. 293–302, doi:10.1007/s13199-018-0559-y
- E. J. Carpenter, J P. Montoya, J. Burns, M R. Mulholland, A. Subramaniam, D G. Capone: Extensive bloom of a N2-fixing diatom/cyanobacterial association in the tropical Atlantic Ocean. In: Marine Ecology Progress Series. 185, 1999, ISSN 0171-8630, S. 273–283. bibcode:1999MEPS..185..273C. doi:10.3354/meps185273.
- S. Janson, J. Wouters, B. Bergman, E. J. Carpenter: Host specificity in the Richelia-diatom symbiosis revealed by hetR gene sequence analysis. In: Environmental Microbiology. 1, Nr. 5, Oktober 1999, S. 431–438. doi:10.1046/j.1462-2920.1999.00053.x. PMID 11207763.
- LPSN:Richelia Schmidt 1902
- WoRMS: Richelia J.Schmidt, 1901 (Schalter „marine only“ deaktivieren)
- AlgaeBase: Richelia J.Schmidt, 1901
- NCBI: Richelia, sowie Richelia Schmidt in Ostenfeld et J. Schmidt 1901 (genus); gaphisch: Richelia, auf: Lifemap, NCBI Version.
- AlgaeBase: Richelia intracellularis J.Schmidt 1901
- C. H. Ostenfeld, Johs. Schmidt: Plankton fra det Røde Hav og Adenbugten (Plankton from the Red Sea and the Gulf of Aden). In: Videnskabelige Meddelelser fra Dansk Naturhistorisk Forening 1901, 1902, S. 141–182 (dänisch).
- Yin-Wu Shen, Z. Y. Zhu, Y. D. Liu: Effects of Different Light Quality on Richelia sinica, in: Acta Hydrobiologica Sinica, Band 23, Nr. 3, 1999, S. 285–287.
- Yin-Wu Shen, Yao-Ying Li: A new species of Richelia of Blue-Green Algae, in: Acta Phytotaxonomica Sinica, Band 27, Nr. 2, 1989, S. 158–159.
- Tracy A. Villareal: Laboratory Culture and Preliminary Characterization of the Nitrogen-Fixing Rhizosolenia-Richelia Symbiosis. In: Marine Ecology. 11, Nr. 2, Juni 1990, S. 117–132. bibcode:1990MarEc..11..117V. doi:10.1111/j.1439-0485.1990.tb00233.x.
- W. Tang, N. Cassar: Data-Driven Modeling of the Distribution of Diazotrophs in the Global Ocean. In: Geophysical Research Letters. 46, Nr. 21, 2019, ISSN 1944-8007, S. 12258–12269. bibcode:2019GeoRL..4612258T. doi:10.1029/2019GL084376.
- Fernando Gómez, Ken Furuya, Shigenobu Takeda: Distribution of the cyanobacterium Richelia intracellularis as an epiphyte of the diatom Chaetoceros compressus in the western Pacific Ocean. In: Journal of Plankton Research. 27, Nr. 4, 1. April 2005, S. 323–330. doi:10.1093/plankt/fbi007.
- E. B. Zeev, T. Yogev, D. Man-Aharonovich, N. Kress, B. Herut, O. Béjà, I. Berman-Frank: Seasonal dynamics of the endosymbiotic, nitrogen-fixing cyanobacterium Richelia intracellularis in the eastern Mediterranean Sea. In: The ISME Journal. 2, Nr. 9, September 2008, S. 911–923. doi:10.1038/ismej.2008.56. PMID 18580972.
- Wei-Lei Wang, J. Keith Moore, Adam C. Martiny, François W. Primeau: Convergent estimates of marine nitrogen fixation. In: Nature. 566, Nr. 7743, Februar 2019, S. 205–211. bibcode:2019Natur.566..205W. doi:10.1038/s41586-019-0911-2. PMID 30760914.
- Tracy A. Villareal, Colbi G. Brown, Mark A. Brzezinski, Jeffrey W. Krause, Cara Wilson: Summer Diatom Blooms in the North Pacific Subtropical Gyre: 2008–2009, in: PLOS ONE, Band 7, Nr. 4, 6. April 2012, e33109, doi:10.1371/journal.pone.0033109
- Sing-How Tuo, Yuh-Ling Lee Chen, Houng-Yung Chen, Tien-Yi Chen: Free-living heterocystous cyanobacteria in the tropical marginal seas of the western North Pacific, in: Journal of Plankton Research, Band 39, Nr. 3, Mai/Juni 2017, S. 404–422, doi:10.1093/plankt/fbx023