Pseudoautosomale Region
Pseudoautosomale Regionen (PAR) sind Abschnitte im Genom mancher Lebewesen, die auf verschiedenen Geschlechtschromosomen der entsprechenden Art homologe DNA-Sequenzen haben.[1] Bei Säugern liegen sie entsprechend auf dem X- und dem Y-Chromosom. PAR sind also in beiden Geschlechtern gleich oft vorhanden, so wie dies sonst bei Autosomen der Fall ist, daher der Name. Durch die PAR wird die Paarung der ansonsten unterschiedlichen Geschlechtschromosomen während der Meiose ermöglicht. Dabei findet eine Rekombinationen im Bereich der PAR durch Crossing-over statt.
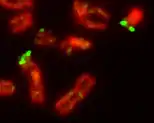

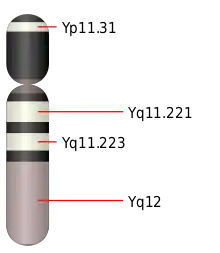
Pseudoautosomale Regionen der Säugetiere
Auf den Geschlechtschromosomen der Säugetiere gibt es zwei PAR:
- PAR1 ist beim Menschen 2,7 Millionen Basenpaare (Mb) groß, befindet sich am Ende des kurzen Arms (des sogenannten p-Arms) der Geschlechtschromosomen und heißt auch p-PAR. Hier findet während der Meiose bei männlichen Individuen ein obligatorisches Crossing-over statt.
- PAR2 ist beim Menschen 0,33 Mb groß, befindet sich am Ende des langen Armes (q-Arm) der Geschlechtschromosomen und heißt auch q-PAR. Hier ist ein Crossing-over während der Meiose bei männlichen Individuen nicht obligatorisch und sogar relativ selten.
Bislang wurden im Bereich der beiden PAR insgesamt ca. 30 Gene identifiziert.[2]
Die Untersuchung der PAR im Y-Chromosom von Pferden (ECAY: Equus caballus Y-Chromosom) war hilfreich bei der Herstellung der ersten Genomkarten der sog. euchromatischen Regionen von ECAY. Solche Untersuchungen sind in tiermedizinischer Hinsicht für die Untersuchung der männlichen Fruchtbarkeit (Fertilität) von Pferden und deshalb auch für Züchtungsfragen bedeutsam.[3] Bei zahlreichen Untersuchungen zu sogenannten Quantitative Trait Loci werden auch die PAR in die Suche mit eingeschlossen. Dabei werden zum Beispiel Marker für die Anfälligkeit (Vulnerabilitätsmarker) für BSE,[4] Marker für Verhalten und Körperbau von Rindern,[5] oder Resistenzen gegen Krankheitserreger gesucht.[6]
Neben den PAR kann es auf Geschlechtschromosomen auch noch weitere homologen Regionen geben, bei denen sich die Sequenzen ähneln (und somit einen gemeinsamen Ursprung haben), aber nicht (mehr) identisch sind. Beim Menschen sind dies Xq21.3 und Yp11.1.
Genetische Besonderheiten
Für die PAR1 ist bekannt, dass es dort sehr viel häufiger als in anderen Bereichen des Genoms zu Rekombinationen kommt. Dabei nimmt die Häufigkeit der Rekombinationen zu, je weiter die betroffenen Genabschnitte in Richtung der Chromosomenenden, also der Telomere, liegen.[7] Das Ausmaß der Rekombinationshäufigkeit scheint dabei bei verschiedenen Spezies deutlich zu differieren.[8] Da man davon ausgeht, dass Genabschnitte, die oft von Rekombinationen betroffen sind, auch häufig von Mutationen betroffen sind, wurden die PAR auf Mutationshäufigkeit untersucht. Zumindest im Falle von Menschen und anderen Primaten sind die PAR sehr viel seltener als erwartet von Mutationen betroffen.[9]
Was die Häufung von Rekombinationen innerhalb der PAR1 betrifft, gibt es einen bemerkenswerten Unterschied zwischen den Verhältnissen bei Menschen und Mäusen, welcher als „PAR-Boundary Paradox“ bezeichnet wird. Wenn man beim Menschen die Genregion untersucht, die die PAR1 von den weiter zur Mitte, also zum Zentromer hin gelegenen Gen-Abschnitten, trennt, zeigt sich, dass innerhalb der PAR1 die Rekombinationshäufigkeit 20-mal höher ist als im übrigen Genom. Gleichzeitig finden sich dort überdurchschnittlich viele GC-Abschnitte.[10] Dabei wird die Häufung an GC-reichen Sequenzen in der PAR1 als evolutionäre Folge der gehäuften Rekombinationen in diesen Genabschnitten interpretiert.[11] Bei Mäusen hingegen gibt es in diesem Chromosomabschnitt keine positive Korrelation von Rekombinationsraten und GC-Gehalt.[12]
Gene in PAR1 und PAR2 im Humangenom
Folgende Gene liegen in den pseudoautosomalen Regionen beim Menschen: ASMT, ASMTL, CD99, CRLF2, CSF2RA, SFRS17A, DHRSXY, GTPBP6, IL3RA, P2RY8, PLCXD1, PPP2R3B, SHOX, SLC25A6, XG, ZBED1, SPRY3, SYBL1, IL9R.[13]
Mit PAR assoziierte Krankheiten des Menschen
Beim Menschen gibt es eine erbliche Erkrankung, die mit Kleinwüchsigkeit und einer Deformation der Speiche (Madelung-Deformität) einhergeht, die sog. Dyschondrosteose Léri Weill (LWD). Diese Krankheit ist eine pseudoautosomal dominante Erkrankung. Das heißt, dass die Gene, die für die Erkrankung verantwortlich sind, in der pseudoautosomalen Region der Geschlechtschromosomen sitzen und der Erbgang dominant ist. Bei der Léri-Weill Dyschondrosteosis (LWD) gibt es Deletionen im Bereich der PAR1.[14] Das bei dieser Erkrankung beteiligte SHOX-Gen ist vermutlich auch an anderen genetischen Erkrankungen (die sog. „Langer mesomelic dysplasia“ und das Turner-Syndrom) mitbeteiligt.[15] Deletionen im Bereich der PAR stehen bei Männern im Zusammenhang mit einer Unfruchtbarkeit (Infertilität), die auf eine Azoospermie (Fehlen von Spermien im Ejakulat) zurückgeht.[16][17] Eine Besonderheit stellen die sogenannten R*Y-Elemente dar. Es handelt sich dabei um DNA-Sequenzen, die eine Dreifachhelix bilden. Diese „Triplexe“ verhindern die Transkription und Replikation der DNA und erhöhen die Wahrscheinlichkeit von genetischen Rearrangements. Auf den Geschlechtschromosomen dienen diese Sequenzen zum Abschalten von Genen. Sie finden sich gehäuft in den Intronen von Genen, die im Gehirn exprimiert werden und möglicherweise eine Rolle bei der Entstehung psychischer Erkrankungen spielen. Da diese Genabschnitte in der Umgebung von schnell mutierten Genen gefunden werden, vermutet man, dass sie bei der Evolution des Genoms eine Rolle spielen.[18] Defekte im Amelogenin-Gen in PAR1 verursachen eine Störung der Zahnschmelzbildung die Amelogenesis imperfecta genannt wird.[19]
PAR bei Pflanzen

Die PAR ist auch bei Pflanzen untersucht worden. Studien zur Meiose bei der Nelkengewächsart Weißen Lichtnelke (Silene latifolia) haben gezeigt, dass die Rekombination nicht zwischen den beiden langen Armen der Geschlechtschromosomen stattfindet, sondern zwischen dem kurzen Arm des X-Chromosoms und dem langen Arm des Y-Chromosoms.[20] Da die Geschlechtschromosomen bei dieser Art sehr jung sind (sie entstanden erst vor etwa 10–20 Mio. Jahren) gilt die Untersuchung der PAR der Weißen Lichtnelke als besonders informativ. Detaillierte Untersuchungen dieser PAR stützen die alte Hypothese, dass die Geschlechtschromosomen aus einem Paar von Autosomen hervorgegangen sind.[21][22]
Evolutionäre Aspekte

PAR2 auf dem Y-Chromosom enthält vier Gene[23] und wurde während der Entwicklung der Säugetiere vermutlich verdoppelt. Untersuchungen über die Lage der PAR2-Gene bei Lemuren, Katzen und dem Derbywallaby ergaben, dass die dafür verantwortlichen Mutationen vor 70 bis 130 Mio. Jahren und vor 60 bis 70 Mio. Jahren erfolgten.[23] Auch scheint die Grenze der PAR2 zu den übrigen Abschnitten auf dem X- und Y-Chromosom nicht ganz scharf zu sein, da bei Säugetieren das Amelogenin-Gen diese Grenze überspannt. Diese Beobachtung wird so interpretiert, dass die Evolution der Geschlechtschromosomen, die bei Säugetieren vor ca. 300 Mio. Jahren begann[24] mit Veränderungen in den Genen (SRY) zu tun hat, die den männlichen Phänotyp determinieren.[25]
Das Y-Chromosom
Beim Menschen ist das Y-Chromosom etwa 65 Mb groß und enthält etwa 78 aktive Gene. Das Y-Chromosom der Schmalfuß-Beutelmäuse ist mit ca. 10 Mb noch kleiner. Es enthält keine PAR, allerdings findet sich auf ihm auch das SRY-Gen. Dieser Befund stützt die Vermutung, dass es zumindest im Falle der Beutelsäuger Marsupialia und der Höheren Säugetiere Eutheria einen gemeinsamen Vorfahren des Y-Chromosoms gibt.[26]
Der autosomale Ursprung des X-Chromosoms

Schon seit längerem wird vermutet, dass sich die Geschlechtschromosomen der Säugetiere aus autosomalen Regionen entwickelt haben. Genetische Untersuchungen haben gezeigt, dass der lange Arm des X-Chromosoms allen Säugetieren gemeinsam ist. Erste Hinweise für einen sukzessiven Prozess der Entstehung des X-Chromosoms fand man bei Vergleichen von Genregionen auf dem kurzen X-Arm: bei Schnabeltieren und Beuteltieren (Marsupialia) fehlen dort Abschnitte, die beim menschlichen X-Chromosom vorhanden sind. Daraus schließt man, dass der gesamte kurze X-Arm erst kürzlich Teil des X-Chromosoms bei den Höheren Säugetieren Eutheria wurde.[27]
Bei allen drei Säugetierunterklassen (Höhere Säugetiere, Beuteltiere und Ursäuger) gibt es übereinstimmende Regionen des X-Chromosoms, allerdings haben Beuteltiere (Marsupialia) und Kloakentiere (Monotremata) eine autosomale Region gemeinsam, die sich bei den Höheren Säugetieren auf dem X-Chromosom befindet. Dies spricht dafür, dass zumindest Teile des X-Chromosoms ursprünglich ein autosomes Chromosom waren. Ähnliches gilt für das Y-Chromosom, nur dass dort der Anteil an genetischem Material, der wohl von Autosomen stammt, noch wesentlich umfangreicher ist.[28]
Das Alter der Geschlechtschromosomen
Für einen autosomalen Ursprung des kurzen X-Armes spricht auch die Untersuchung der chromosomalen Lokalisation des Amelogenin-Gens (AMG) beim Derbywallaby (Marsupialia), dem Schnabeltier (Monotremata) und dem Menschen (Eutheria). Bei Wallaby und Schnabeltier sitzt AMG auf den Autosomen 5q und 1q sowie 1 und 2 und beim Menschen auf Xp22 und Yp11 (also jeweils in der PAR1).[29] Aufgrund der Vermutung, dass die Radiation der Säugetiere aus einem gemeinsamen Vorfahren vor ca. 150 Mio. Jahren stattfand schließt man, dass AMG vor 80 bis 150 Mio. Jahren den PAR hinzugefügt wurde und dass X- und Y-Chromosomen mindestens so alt sind.[30]
Siehe auch
Einzelnachweise
- J. A. Graves, M. J. Wakefield, R. Toder: The origin and evolution of the pseudoautosomal regions of human sex chromosomes. In: Hum Mol Genet. 7(13), Dez 1998, S. 1991–1996. PMID 9817914
- R. J. Blaschke, G. Rappold: The pseudoautosomal regions, SHOX and disease. In: Curr Opin Genet Dev. 16(3), Jun 2006, S. 233–239. Epub 2006 May 2. PMID 16650979
- T. Raudsepp u. a.: A detailed physical map of the horse Y chromosome. In: Proc Natl Acad Sci U S A. 101(25), 22. Jun 2004, S. 9321–9326. Epub 2004 Jun 14. PMID 15197257
- C. Zhang u. a.: Mapping of multiple quantitative trait loci affecting bovine spongiform encephalopathy. In: Genetics. 167(4), Aug 2004, S. 1863–1872. PMID 15342524
- S. Hiendleder u. a.: Mapping of QTL for Body Conformation and Behavior in Cattle. In: J Hered. 94(6), Nov–Dec 2003, S. 496–506. PMID 14691316
- G. Reiner u. a.: Detection of quantitative trait loci for resistance/susceptibility to pseudorabies virus in swine. In: J Gen Virol. 83(Pt 1), Jan 2002, S. 167–172. PMID 11752713
- D. A. Filatov: A gradient of silent substitution rate in the human pseudoautosomal region. In: Mol Biol Evol. 21(2), Feb 2004, S. 410–417. Epub 2003 Dec 5. PMID 14660686
- S. W. Huang u. a.: How strong is the mutagenicity of recombination in mammals? In: Mol Biol Evol. 22(3), Mar 2005, S. 426–431. Epub 2004 Oct 20. PMID 15496551
- S. Yi u. a.: Recombination has little effect on the rate of sequence divergence in pseudoautosomal boundary 1 among humans and great apes. In: Genome Res., 14(1), Jan 2004, S. 37–43. Epub 2003 Dec 12. PMID 14672979
- J. F. Chen u. a.: Significant positive correlation between the recombination rate and GC content in the human pseudoautosomal region. In: Genome. 49(5), Mai 2006, S. 413–419. PMID 16767166
- J. Meunier, L. Duret: Recombination drives the evolution of GC-content in the human genome. In: Mol Biol Evol. 21(6), Jun 2004, S. 984–990. Epub 2004 Feb 12. PMID 14963104
- N. Galtier: Recombination, GC-content and the human pseudoautosomal boundary paradox. In: Trends Genet. 20(8), Aug 2004, S. 347–349. PMID 15262406
- Helena A. Mangs, B. J. Morris: The Human Pseudoautosomal Region (PAR): Origin, Function and Future. In: Curr. Genomics. Band 8, Nr. 2, April 2007, S. 129–136, doi:10.2174/138920207780368141, PMID 18660847, PMC 2435358 (freier Volltext).
- S. Benito-Sanz u. a.: A novel class of Pseudoautosomal region 1 deletions downstream of SHOX is associated with Leri-Weill dyschondrosteosis. In: Am J Hum Genet. 77(4), Oct 2005, S. 533–544. Epub 2005 Aug 15. PMID 16175500
- K. U. Schneider u. a.: Identification of a major recombination hotspot in patients with short stature and SHOX deficiency. In: Am J Hum Genet. 77(1), Jul 2005, S. 89–96. Epub 2005 Jun 1. PMID 15931595
- O. Gabriel-Robez u. a.: Deletion of the pseudoautosomal region and lack of sex-chromosome pairing at pachytene in two infertile men carrying an X;Y translocation. In: Cytogenet Cell Genet. 54(1–2), 1990, S. 38–42. PMID 2249473
- Y. H. Lin u. a.: Ring (Y) in two azoospermic men. In: Am J Med Genet A., 128(2), 15. Jul 2004, S. 209–213. PMID 15214019
- A. Bacolla u. a.: Long homopurine*homopyrimidine sequences are characteristic of genes expressed in brain and the pseudoautosomal region. In: Nucleic Acids Res. 34(9), 19. Mai 2006, S. 2663–2675. PMID 16714445
- G. Stephanopoulos, M. E. Garefalaki, K. Lyroudia: Genes and related proteins involved in amelogenesis imperfecta. In: J Dent Res. 84(12), Dez 2005, S. 1117–1126. PMID 16304440
- M. Lengerova u. a.: The sex chromosomes of Silene latifolia revisited and revised. In: Genetics. 165(2), Okt 2003, S. 935–938. PMID 14573500
- D. A. Filatov: Evolutionary history of Silene latifolia sex chromosomes revealed by genetic mapping of four genes. In: Genetics. 170(2), Jun 2005, S. 975–979. Epub 2005 Apr 16. PMID 15834147
- S. Ohno: Sex Chromosomes and Sex-Linked Genes. Springer-Verlag, Berlin 1967.
- F. J. Charchar u. a.: Complex events in the evolution of the human pseudoautosomal region 2 (PAR2). In: Genome Res. 13(2), Feb 2003, S. 281–286. PMID 12566406
- J. A. M. Graves: The rise and fall of SRY. In: Trends Genet. 18, 2002, S. 259–264. PMID 12047951
- M. Iwase u. a.: The amelogenin loci span an ancient pseudoautosomal boundary in diverse mammalian species. In: Proc Natl Acad Sci U S A. 100(9), 29. Apr 2003, S. 5258–5263. Epub 2003 Apr 2. PMID 12672962
- R. Toder, M. J. Wakefield, J. A. Graves: The minimal mammalian Y chromosome – the marsupial Y as a model system. In: Cytogenet Cell Genet. 91(1–4), 2000, S. 285–292. PMID 11173870
- J. M. Watson u. a.: Sex chromosome evolution: platypus gene mapping suggests that part of the human X chromosome was originally autosomal. In: Proc Natl Acad Sci U S A. 88(24), 15. Dez 1991, S. 11256–11260. PMID 1763040
- P. D. Waters u. a.: The human Y chromosome derives largely from a single autosomal region added to the sex chromosomes 80–130 million years ago. In: Cytogenet Cell Genet. 92(1–2), 2001, S. 74–79. PMID 11306800
- E. C. Salido, P. H. Yen, K. Koprivnikar, L. C. Yu, L. J. Shapiro: The human enamel protein gene amelogenin is expressed from both the X and the Y chromosomes. In: Am J Hum Genet. 50(2), Feb 1992, S. 303–316. PMID 1734713
- J. M. Watson u. a.: Autosomal localization of the amelogenin gene in monotremes and marsupials: implications for mammalian sex chromosome evolution. In: Genomics, 14(3), Nov 1992, S. 785–789. PMID 1427909