Pschorr-Cyclisierung
Die Pschorr-Cyclisierung ist eine Namensreaktion der organischen Chemie, die nach ihrem Entdecker, dem deutschen Chemiker Robert Pschorr (1868–1930), benannt wurde. Sie beschreibt die intramolekulare Substitution aromatischer Verbindungen über Aryldiazoniumsalze als Zwischenstufe und wird durch Kupfer katalysiert. Es handelt sich bei dieser Reaktion um eine Variante der Gomberg-Bachmann-Reaktion.[1]

Übersichtsreaktion
Ursprünglich wurde die Pschorr-Cyclisierung zur Gewinnung von Phenanthren und Phenanthrenderviaten entwickelt. Das folgende Reaktionsschema zeigt beispielhaft die Synthese von Phenanthren mittels der Pschorr-Cyclisierung:[2]
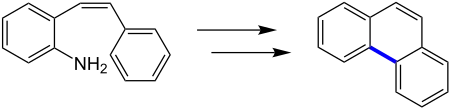
Reaktionsmechanismus
Im Zuge der Pschorr-Cyclisierung kommt es zunächst zu einer Diazotierung der Ausgangsverbindung, so dass sich als Zwischenstufe ein Aryldiazoniumsalz ergibt. Dazu wird im Vorfeld der Reaktion Natriumnitrit zu Salzsäure gegeben, um Salpetrige Säure zu erhalten. Die Salpetrige Säure wird im Anschluss protoniert und mit einem weiteren Äquivalent Salpetriger Säure umgesetzt. Daraufhin entsteht Zwischenstufe 1, welche später zur Diazotierung des aromatischen Amins genutzt wird:

Nun soll entsprechend der Übersichtsreaktion ein möglicher Reaktionsmechanismus für die Pschorr-Cyclisierung beschrieben werden:[3]

Mittels der Zwischenstufe 1 erfolgt die Substitution eines Wasserstoffatoms von der Aminogruppe der Ausgangsverbindung. Als neuer Substituent wird eine Nitrosogruppe eingeführt. Außerdem wird Salpetrige Säure abgespalten und es geht Zwischenstufe 2 hervor. Diese reagiert anschließend über eine Tautomerie und Wasserabspaltung zum Aryldiazonium-Kation 3.

Durch Einsatz des Kupferkatalysator wird nun Stickstoff vom Aryldiazonium-Kation 3 abgespalten, so dass sich ein Aryl-Radikal bildet, das über eine Ringschließung zur Zwischenstufe 4 reagiert. Schließlich erfolgt unter erneuter Verwendung des Kupferkatalysators die Rearomatisierung und es wird Phenanthren gewonnen.
Atomökonomie
Die Pschorr-Cyclisierung weist eine verhältnismäßig gute Atomökonomie auf, da als Abfallstoff im Wesentlichen nur Stickstoff auftritt. Zur Diazotierung werden zwei Äquivalente Salpetrige Säure verwendet, wobei ein Äquivalent im Reaktionsverlauf zurückgebildet wird. Der Einsatz von Kupfer erfolgt katalytisch und wirkt sich demnach nicht negativ auf die Atomeffizienz der Reaktion aus. Bei der Betrachtung ökonomischer Gesichtspunkte ist allerdings auch zu beachten, dass die Pschorr-Cyclisierung häufig nur geringe Ausbeuten liefert.[2][3]
Einzelnachweise
- Robert Pschorr: Neue Synthese des Phenanthrens und seiner Derivate. In: Berichte der deutschen chemischen Gesellschaft. Band 29, Nr. 1, 1896, S. 496–501, doi:10.1002/cber.18960290198.
- Ivica Cepanec: Synthesis of biaryls. 1. edition Auflage. Elsevier, Amsterdam 2004, ISBN 978-0-08-044412-3, S. 25–27.
- Jie Jack Li: Name reactions: A collection of detailed mechanisms and synthetic applications. 5. edition Auflage. Springer, Cham 2014, ISBN 978-3-319-03979-4, S. 499–500, doi:10.1007/978-3-319-03979-4.