Graebe-Ullmann-Synthese
Die Graebe-Ullmann-Synthese, häufig auch als Grabe-Ullmann-Thermolyse oder Grabe-Ullmann-Carbazol-Synthese bezeichnet, ist eine Namensreaktion der organischen Chemie. Sie wurde zum ersten Mal 1896 von den deutschen Chemikern Carl James Peter Graebe (1841–1927) und Fritz Ullmann (1875–1939) veröffentlicht. Mit ihrer Hilfe kann man Carbazole herstellen.[1][2]
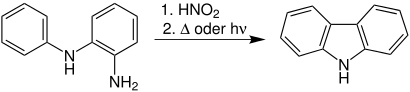
Die Reaktion kann thermisch, photochemisch oder unter dem Einfluss von Mikrowellenstrahlung ablaufen.[3]
Mechanismus
Die Darstellung zeigt den nach Zerong Wang[1] postulierten Mechanismus am Beispiel der Reaktion von ortho-Aminodiphenylamin zu Carbazol:

Zunächst diazotiert man die primäre Aminogruppe im Diphenylaminderivat 1 mit Salpetriger Säure. Man erhält damit das Diazoniumsalz 2, welches durch einen intramolekularen Angriff zum Kation 3 cyclisiert. Durch die Abspaltung eines Protons erhält man das Triazol 4. Aus diesem spaltet sich nun Stickstoff ab und es entsteht das Radikal 5. Durch eine radikalische Umlagerung entsteht aus 5 nun das Carben-Intermediat 6. Anschließend findet eine Cyclisierung statt, bei der man das Carbazolderivat 7 erhält, welches über einen [1,3]-Protonentransfer zu Carbazol (8) aromatisiert.
Durch Analysen konnte festgestellt werden, dass diese Reaktion die Cyclisierung eines Carbens zu einem Carbazolderivat beinhaltet. Außerdem ist bekannt, dass das Carbazolderivat über einen [1,3]-Protonentransfer zu Carbazol reagiert. Auf Grund dieser bekannten Fakten konnte der dargestellte Mechanismus erschlossen werden.[4] Mit Hilfe dieser Reaktion ist es außerdem auch möglich, komplexere heterocyclische Verbindungen – z. B. Pyrrol-Derivate – zu synthetisieren.[1]
Beispiel
Das folgende Beispiel soll die praktische Anwendbarkeit der Graebe-Ullmann-Synthese zeigen:[5]
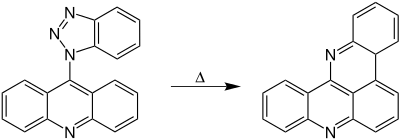
Die Reaktion zeigt die Graebe-Ullmann-Synthese eines Chinolin-Derivats. Statt des hier eingezeichneten Phenylringes können sich an dem Triazolring auch andere Reste befinden.[5]
Einzelnachweise
- nach: Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 1 Volume Set. John Wiley & Sons, Hoboken, New Jersey, 2009, ISBN 978-0-471-70450-8, S. 1256–1259.
- C. Graebe, F. Ullmann: Ueber eine neue Carbazolsynthese. In: Justus Liebig's Annalen der Chemie. 291, 1896, S. 16–17, doi:10.1002/jlac.18962910104.
- Andrés Molina u. a.: Synthesis and DNA Binding Properties of γ-Carbolinium Derivatives and Benzologues. In: The Journal of Organic Chemistry. Band 61, Nr. 16, 1996, S. 5587–5599, doi:10.1021/jo960266h.
- Alan R. Katritzky, Xiangfu Lan, Jason Z. Yang, Olga V. Denisko: Properties and Synthetic Utility of N-Substituted Benzotriazoles. In: Chem. Rev. Band 98, Nr. 2, 1998, S. 409–548, doi:10.1021/cr941170v.
- Johnson Stanslas et al.: Antitumor Polycyclic Acridines. 7.1 Synthesis and Biological Properties of DNA Affinic Tetra- and Pentacyclic Acridines. In: J. Med. Chem. Nr. 43, 2000, S. 1563–1572, doi:10.1021/jm9909490.