Propanthialoxid
Propanthialoxid (genauer Propanthial-S-oxid) ist eine chemische Verbindung und das einzige bisher bekannte natürlich vorkommende Thiocarbonyl-S-oxid. Sie kommt in zwei isomeren Formen vor.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
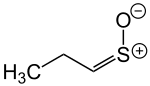 | ||||||||||
| Strukturformel der syn-Form | ||||||||||
| Allgemeines | ||||||||||
| Name | Propanthialoxid | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C3H6OS | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 90,14 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Natürliche Entstehung

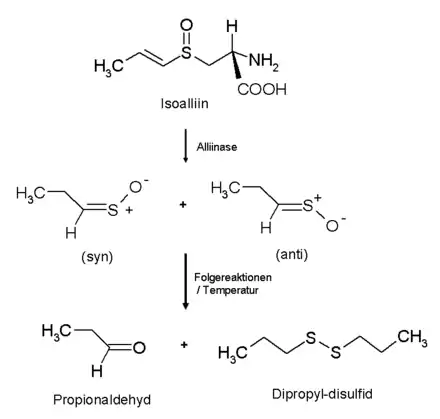
Die Verbindung ist der aus Isoalliin durch das Enzym Alliinase freigesetzte Tränenreizstoff der Zwiebel (Allium cepa), der zu ca. 95 % in der (Z)-Form vorliegt.[2]
Wird die Zwiebel verletzt, entsteht aus Isoalliin im ersten Schritt durch Abspaltung des Alaninfragmentes mittels der Alliinase und dem Enzym Co-Faktor Pyridoxalphosphat die 1-Propensulfensäure, welche durch tautomere Wasserstoffumlagerung zu dem sogenannten tränenreizenden Faktor (engl. lacrimatory factor, LF), dem Propanthialoxid in zwei isomeren Formen (syn- und anti-) wird, wobei die syn-Form das Hauptprodukt darstellt.[3] Diese ist sehr reaktiv und kann zu Propionaldehyd, Schwefelsäure und Schwefelwasserstoff hydrolysieren, aber auch Cycloadditionen mit sich selbst zu Vier- und Fünfringverbindungen eingehen. Bei den höheren Temperaturen der Wasserdampfdestillation bei 100 °C und natürlich auch beim Kochen oder Braten bildet sich neben Propionaldehyd auch Dipropyldisulfid.
Eigenschaften
Propanthialoxid hydrolysiert mit Wasser leicht unter Freisetzung von Propionaldehyd, Schwefelsäure und Schwefelwasserstoff.[2]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Gerhard Eisenbrand, Alfred Hagen Meyer, Peter Schreier: RÖMPP Lexikon Lebensmittelchemie, 2. Auflage, 2006. Georg Thieme, 2014, S. 2006 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Legrum: Riechstoffe, Zwischen Gestank und Duft: Vorkommen, Eigenschaften und Anwendung von Riechstoffen und deren Gemischen. Springer-Verlag, 2011, S. 90 (eingeschränkte Vorschau in der Google-Buchsuche).