Prenol
Prenol (3-Methyl-2-buten-1-ol) ist eine chemische Verbindung aus der Gruppe der Alkenole, genauer der Methylbutenole.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
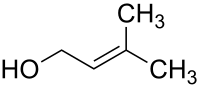 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Prenol | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C5H10O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 86,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,85 g·cm−3[2] | |||||||||||||||
| Siedepunkt |
140 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser (170 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Brechungsindex |
1,443 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen

Natürlich kommt 3-Methyl-2-buten-1-ol in Noni (Morinda citrifolia), Schwarzen Johannisbeeren (Ribes nigrum) und Himbeeren (Rubus idaeus) vor.[4]
Gewinnung und Darstellung
Zur industriellen Synthese von Prenol setzt man zunächst Isobuten mit flüssigem Formaldehyd bei Temperaturen von 200–300 °C und Drücken von 250 bar katalysatorfrei in einem Reaktor um. Dabei entsteht zunächst die isomere Verbindung Isoprenol.[5][6]
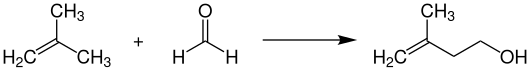
Im Anschluss wird das entstandene Isoprenol bei Temperaturen von 50–110 °C und Drücken von 2–20 bar an Palladium-Katalysatoren, welche auf Aktivkohle geträgert sind, zu Prenol isomerisiert.[7]
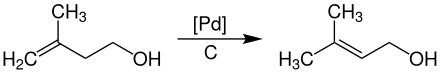
Die Aufarbeitung und Reinigung der Produkte erfolgt durch mehrstufige Destillation unter Druck in Rektifikationskolonnen.[5]
Eigenschaften
Prenol ist eine entzündliche farblose Flüssigkeit mit fruchtigem Geruch, welche leicht löslich in Wasser ist.[2]
Vorkommen und Verwendung
Prenol kommt als Baustein bei der Biogenese und der industriellen Herstellung von Isoprenoiden (Polyprenole) vor.[2]
Sicherheitshinweise
Die Dämpfe von Prenol können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 50 °C, Zündtemperatur 305 °C) bilden.[2]
Einzelnachweise
- Eintrag zu PRENOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. September 2021.
- Eintrag zu 3-Methyl-2-buten-1-ol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Datenblatt 3-Methyl-2-buten-1-ol, 99 % bei Sigma-Aldrich, abgerufen am 29. Januar 2019 (PDF).
- 3-METHYL-2-BUTEN-1-OL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 11. September 2021.
- H. Pommer, A. Nürrenbach: INDUSTRIAL SYNTHESIS OF TERPENE COMPOUNDS. In: Organic Synthesis. 1975, S. 527–551, doi:10.1016/B978-0-408-70725-1.50016-1. ISBN 978-0-408-70725-1 (Buchkapitel)
- Hans Martin Weitz, Eckhard Loser: Isoprene. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. Juni 2000, S. 86, doi:10.1002/14356007.a14_627.
- Patent EP3429982B1: Verfahren zur Herstellung von Prenol und Prenal aus Isoprenol. Angemeldet am 14. März 2017, veröffentlicht am 10. Juni 2020, Anmelder: BASF AG, Erfinder: Martine Dehn, Bernhard Brunner, Klaus Ebel, Sabine Huber.


