Praseodym(III)-chlorid
Praseodym(III)-chlorid ist eine chemische Verbindung aus der Gruppe der Chloride.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
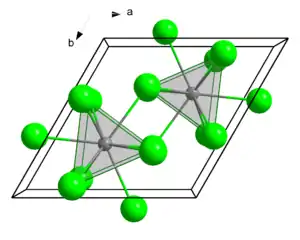 | ||||||||||
| _ Pr3+ _ Cl− | ||||||||||
| Kristallsystem | ||||||||||
| Raumgruppe |
P63/m (Nr. 176) | |||||||||
| Koordinationszahlen |
Pr[9], Cl[3] | |||||||||
| Allgemeines | ||||||||||
| Name | Praseodym(III)-chlorid | |||||||||
| Andere Namen |
Praseodymtrichlorid | |||||||||
| Verhältnisformel | PrCl3 | |||||||||
| Kurzbeschreibung |
grün-blauer geruchloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 247,27 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
1710 °C[3] | |||||||||
| Löslichkeit |
löslich in Wasser (96,1 g/100 g bei 25 °C) und Ethanol[4] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Praseodym(III)-chlorid kann durch Reaktion von Praseodym mit Chlorwasserstoff gewonnen werden.[5][6]
Die Hydrate können durch Reaktion von Praseodym oder Praseodym(III)-carbonat mit Salzsäure gewonnen werden.
Die wasserfreie Form kann durch thermische Dehydrierung bei 400 °C in Gegenwart von Ammoniumchlorid erhalten werden.[7][8] Als Alternative kann auch Thionylchlorid verwendet werden.[9]
Eigenschaften
-chloride-heptahydrate.jpg.webp)
Praseodym(III)-chlorid ist ein hygroskopischer grün-blauer Feststoff, als Heptahydrat grüner Feststoff.[1] Das Anhydrat wandelt sich an Luft schnell in das Heptahydrat um. Er liegt in einem hexagonalen Kristallsystem mit der Raumgruppe P63/m (Nr. 176) vor. Sein Heptahydrat besitzt eine trikline Kristallstruktur mit der Raumgruppe P1 (Nr. 1).[2]
Verwendung
Praseodym(III)-chlorid wird als Laborchemikalie und zur Herstellung anderer chemischer Verbindungen verwendet.[1]
Einzelnachweise
- Datenblatt Praseodym(III) chloride, anhydrous, powder, 99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 23. April 2012 (PDF).
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 2007, ISBN 978-3-540-60035-0 (Seite 672 in der Google-Buchsuche).
- Praseodym(III)chlorid bei webelements.com, abgerufen am 12. Oktober 2012.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 89. Auflage. (Internet-Version: 2009), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-84.
- Leonard F. Druding, John D. Corbett: „Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide“, in: J. Am. Chem. Soc., 1961, 83, S. 2462–2467 (doi:10.1021/ja01472a010).
- J. D. Corbett: „Reduced Halides of the rare-earth elements“, in: Rev. Chim. Minerale, 1973, 10, S. 239–257.
- M. D. Taylor, P. C. Carter: „Preparation of anhydrous lanthanide halides, especially iodides“, in: J. Inorg. Nucl. Chem., 1962, 24, S. 387–391 (doi:10.1016/0022-1902(62)80034-7).
- J. Kutscher, A. Schneider, „Notiz zur Präparation von wasserfreien Lanthaniden-Halogeniden, Insbesondere von Jodiden“, in: Inorg. Nucl. Chem. Lett., 1971, 7, S. 815–819 (doi:10.1016/0020-1650(71)80253-2).
- J. H. Freeman, M. L. Smith: „The preparation of anhydrous inorganic chlorides by dehydration with thionyl chlorid“, in: J. Inorg. Nucl. Chem., 1958, 7, S. 224–227 (doi:10.1016/0022-1902(58)80073-1).
