Phenylephrin
Phenylephrin gehört zu den direkt wirkenden Sympathomimetika mit teilweise indirekter Wirkung. Es wirkt als Agonist am α1-Adrenozeptor. Phenylephrin ist bis auf eine fehlende 4-Hydroxygruppe strukturgleich mit Adrenalin und wird in Europa hauptsächlich als lokaler Vasokonstriktor verwendet, z. B. als Wirkstoff von Nasentropfen zum Abschwellen der Schleimhäute im Naseninneren. In Augentropfen wirkt es als Mydriatikum, führt also zu einer Weitstellung der Pupillen. International wird Phenylephrin – u. a. im Rahmen der Geburtshilfe – auch als Vasopressor verwendet.[4][5] In Medikamenten wird das Hydrochlorid und das Tartrat verwendet.[1] Die Wirkung ist am ehesten mit der von Noradrenalin vergleichbar.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
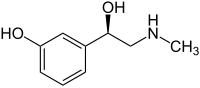 | ||||||||||||||||||||||
| Strukturformel von (R)-Phenylephrin | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Phenylephrin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C9H13NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 167,21 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||||||||
| pKS-Wert |
8,9; 10,1[1] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakokinetik
Nach Gabe von Tritium-markiertem (3H-Phenylephrin) per Infusion oder oral bei Menschen, ergab eine Analyse mittels Ionenaustausch- und Dünnschichtchromatographie eine Ausscheidung von 86 (i.v.) bzw. 80 (p.o.) Prozent der verabreichten Aktivität im Urin; womit eine vollständige enterale Aufnahme angenommen wird. Der Unterschied in der Menge des freien 3H-Phenylephrin im Serum von 16 % der verabreichten Menge bei der i.v. Applikation gegenüber von 2,6 % bei der oralen, lässt auf eine verminderte Bioverfügbarkeit der Substanz schließen. Die biologische Halbwertszeit von zwei bis drei Stunden, wie auch die Clearance von 2 L/h, ist mit strukturell verwandten Aminen vergleichbar.
Die Verstoffwechslung zu phenolischen Konjugaten nach oraler Aufnahme bzw. m-Hydroxymandelsäure nach intravenöser Injektion zeigen, dass m-hydroxylierte Amine im first-pass-Metabolismus vorwiegend konjugiert werden.[6]
Handelsnamen
- Nasenspray für Kinder® (CH)
- Neosynephrin® (A, D)
- Rexophtal® N UD (CH)
- Thalia® (A)
- Vibrocil® (A, CH)
- Visadron® (D, A)
- Metaoxedrin® (DK)
- Mesatonum
Weblinks
- 3D-Struktur von Phenylephrin
- Eintrag zu Phenylephrin bei Vetpharm, abgerufen am 11. August 2012.
Einzelnachweise
- Eintrag zu Phenylephrin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Juli 2019.
- Datenblatt (R)-(−)-Phenylephrine hydrochloride bei Sigma-Aldrich, abgerufen am 19. April 2011 (PDF).
- Datenblatt Phenylephrine (PDF) beim EDQM, abgerufen am 21. Juni 2008.
- D. W. Cooper, P. Mowbray: Advantages of using a prophylactic phenylephrine infusion during spinal anaesthesia for caesarean section. In: International Journal of Obstetric Anesthesia. Bd. 13, Nr. 2, 2004, S. 124–125, PMID 15321421, doi:10.1016/j.ijoa.2003.11.001.
- W. D. Ngan Kee, K. S. Khaw, F. F. Ng: Comparison of phenylephrine infusion regimens for maintaining maternal blood pressure during spinal anaesthesia for Caesarean section. In: British Journal of Anaesthesia. Bd. 92, Nr. 4, April 2004, S. 469–474, PMID 14977792, doi:10.1093/bja/aeh088.
- J. H. Hengstmann, J. Goronzy: Pharmacokinetics of 3H-phenylephrine in man. In: European Journal of Clinical Pharmacology. Bd. 21, Nr. 4, 1982, S. 335–341, PMID 7056280, doi:10.1007/BF00637623.