Phenanthridin
Phenanthridin ist eine chemische Verbindung aus der Gruppe der stickstoffhaltigen Heterocyclen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
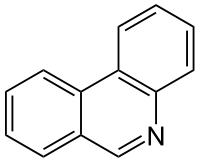 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Phenanthridin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C13H9N | |||||||||||||||
| Kurzbeschreibung |
hellbrauner kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 179,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
löslich in Methanol[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Phenanthridin wurde 1889 zuerst von Amé Jules Pictet und H. Jan Ankersmit aus Benzalanilin durch Pyrolyse im Glührohr synthetisiert.[3] Seine Derivate kommen natürlich in Amaryllidoideae vor.
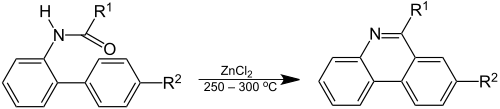
Bei der Pictet-Hubert-Reaktion (1899) entsteht die Verbindung bei der Reaktion eines 2-Aminobiphenyl-Formaldehyd-Adduktes (ein N-Acyl-o-xenylamin) mit Zinkchlorid bei erhöhten Temperaturen.[4] Die Reaktionsbedingungen wurden durch Morgan und Walls 1931 durch Ersatz des Metalles durch Phosphoroxychlorid und Verwendung von Nitrobenzol als Lösungsmittel verwendet.[5] Aus diesem Grund wird die Reaktion auch Morgan-Walls-Reaktion genannt.[6]
Die Reaktion ist ähnlich zur Bischler-Napieralski-Reaktion und der Pictet-Spengler-Reaktion. Auch die Herstellung beginnend mit Phenanthrachinon, N-Methylcarbazol, Fluorenonoxim oder Phenanthridonen ist möglich.[7]
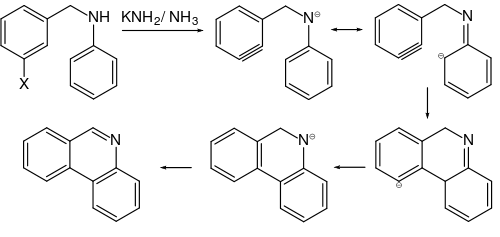
Aus halogenierten Benzylarylaminen können Phenanthridin und seine Derivate über Arine als Zwischenstufe synthetisiert werden.[8]
Eigenschaften
Phenanthridin ist ein hellbrauner kristalliner Feststoff.[1] Phenanthridin und seine Derivate sind tertiäre Basen und bilden mit Säuren Monosäuresalze.[9]
Verwendung
Phenanthridin stellt die Grundstruktur einiger Alkaloide (z. B. Fagaronin, genauer Hydrobenzo[c]-Phenanthridine), Arzneistoffe (z. B. Isometamidium) und anderer chemischer Verbindungen (z. B. Ethidiumbromid) dar.
Siehe auch
- Phenanthren, der stickstofffreie Stammkern
- Acridin, das nichtanguläre Isomer
Einzelnachweise
- Datenblatt Phenanthridin bei Sigma-Aldrich, abgerufen am 18. Januar 2011 (PDF).
- Eintrag zu Phenanthridin bei TCI Europe, abgerufen am 27. Juni 2011.
- Amé Pictet, H. J. Ankersmit (Chemisches Laboratorium der Universität Genf): Mittheilung Ueber das Phenanthridin; In: Justus Liebigs Annalen der Chemie, Volume 266, Issue 1–2, S. 138–153 (doi:10.1002/jlac.18912660107).
- Amé Pictet, A. Hubert: Mittheilungen Ueber eine neue Synthese der Phenanthridinbasen; In: Berichte der deutschen chemischen Gesellschaft, Volume 29, Issue 2, S. 1182–1189, 1896 (doi:10.1002/cber.18960290206).
- Gilbert T. Morgan, Leslie Percy Walls: CCCXXXV.—Researches in the phenanthridine series. Part I. A new synthesis of phenanthridine homologues and derivatives; In: J. Chem. Soc., 1931, S. 2447–2456 (doi:10.1039/JR9310002447).
- Jie Jack Li: Name Reactions in Heterocyclic Chemistry. 1. Auflage. 2005, ISBN 0-471-30215-5.
- C. F. Allen, Lindsey Allen, Richard Allen: The Chemistry of Heterocyclic Compounds, Six Membered Heterocyclic Nitrogen; ISBN 978-0-470-37851-9.
- S. V. Kessar: Some new aspects of benzyne and radical mediated cyclisations. (PDF; 214 kB) In: Journal of Chemical Sciences, 1988, Band 100, Nr. 2–3, S. 217–222, doi:10.1007/BF02839449 (zurzeit nicht erreichbar).
- Raj K. Bansal; Heterocyclic Chemistry; ISBN 81-224-1212-2.
Weblinks
- Kerstin Schulte: Synthese von Phenanthridin- und Benzo[c]phenanthridin-Derivaten und Untersuchungen auf ihre biologische Wirkung. Dissertation, Universität Kaiserslautern 2000.