p-v-T-Diagramm
Ein p-v-T-Diagramm ist in der Physikalischen Chemie und in der Thermodynamik die dreidimensionale Darstellung der Zustände eines thermodynamischen Systems mit den Zustandsgrößen Druck p, spezifisches Volumen v und Temperatur T. Aus einem solchen Zustandsdiagramm lässt sich qualitativ der thermodynamische Gleichgewichtszustand des Systems unter gegebenen Bedingungen ablesen. Kann das System in verschiedenen Aggregatzuständen vorkommen, so lassen sich dem Diagramm deren jeweilige Existenzbereiche entnehmen. In diesem Zusammenhang wird das Diagramm auch als Phasendiagramm bezeichnet.
Zustandsdiagramm
Wie die Erfahrung zeigt, wird der Zustand einer fluiden Phase eines reinen Stoffes (oder eines Fluidgemisches mit konstanter Zusammensetzung) durch Angabe zweier unabhängiger intensiver Zustandsgrößen und einer extensiven Zustandsgröße eindeutig festgelegt.[1] Die extensive Zustandsgröße enthält dabei die Stoffmenge des betrachteten Systems. Ist dessen Menge nicht von Belang, so genügen die verbleibenden zwei intensiven Zustandsgrößen, um den Zustand des Systems eindeutig festzulegen. Hierfür können beispielsweise die messbaren Größen spezifisches Volumen v und Temperatur T gewählt werden. Diesem Wertepaar ist dann eindeutig ein Punkt auf der Zustandsfläche zugeordnet, zu dem ein bestimmter Druck gehört. Ebenso ergibt sich aus der Wahl eines Wertepaares Druck und Temperatur das zugehörige spezifische Volumen.
Dieses dreidimensionale Diagramm bietet eine übersichtliche Darstellung der unterschiedlichen Zustände, ist jedoch zum Abgreifen konkreter Daten ungeeignet.
Die Projektionen dieses Diagrammes in die drei Ebenen (p-v-Ebene, p-T-Ebene und T-v-Ebene) sind jedoch viel verwendete Arbeitsdiagramme, da die Werte an den Koordinaten ablesbar sind. Das bekannteste ist das p-v-Diagramm.
Je nach Bedarf wird auch statt der intensiven Größe v die extensive Größe V verwendet, zum Beispiel für den Vorgang in einem Kolbenmotor mit bestimmten Zylinderabmessungen.
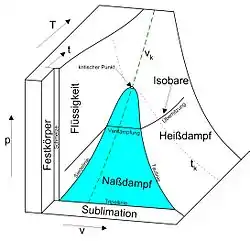
Phasendiagramm
.de.svg.png.webp)
Da, wie in den beiden Abbildungen gezeigt, meist das Zustandsverhalten von Stoffen oder Stoffgemischen in allen drei Phasen dargestellt wird (Aggregatzustände „fest“, „flüssig“ und „gasförmig“), werden das p-v-T-Diagramm und seine Projektionen auch als Phasendiagramme bezeichnet.
Ein solches Phasendiagramm enthält typischerweise
- Bereiche, in denen nur eine Phase existiert, in denen also das gesamte System beispielsweise fest oder flüssig ist.
- Bereiche, in denen zwei verschiedene Phasen gemeinsam vorkommen, in denen also das System beispielsweise halb geschmolzen ist. Der im Diagramm dargestellte Druck ist dann der beiden Phasen gemeinsame Gleichgewichtsdruck, also beispielsweise der Dampfdruck in einem System, das aus einer Flüssigkeits- und einer Gasphase besteht. Beide Phasen haben auch dieselbe Temperatur.
- einen Bereich (Tripellinie), in dem alle drei Phasen gemeinsam koexistieren können. Die drei Phasen haben denselben Druck und dieselbe Temperatur (bei Wasser 0,01 °C und 611,657 ± 0,010 Pa).
Als kritischer Punkt wird jener Zustand bezeichnet, bei dem Siedelinie und Taulinie zusammenlaufen. Bei isobarer Wärmezufuhr mit kritischem Druck (bei Wasser 221,2 bar) - und darüber - geht die flüssige Phase ohne einen Verdampfungsvorgang in die gasförmige Phase über (Die Isobare durchläuft nicht das Nassdampfgebiet).
Siehe auch
- Das p-v-T-Diagramm ist die graphische Darstellung der thermischen Zustandsgleichung des Systems, welche ebenfalls die Variablen p, v und T für die Zustandsbeschreibung benutzt.
Einzelnachweise
- H.D. Baehr: Thermodynamik. 12. Auflage, Springer, Berlin / Heidelberg / New York 2005, ISBN 3-540-23870-0, S. 20.
Weblinks
- Video: Zustandsdiagramm eines Einkomponentensystems - wie beschreibt man einen reinen Stoff mit Zahlen?. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15646.