Pentasilan
Pentasilan ist eine chemische Verbindung der Elemente Silicium und Wasserstoff und zählt damit zur Gruppe der Silane. Die Substanz mit der Halbstrukturformel SiH3–(SiH2)3–SiH3 ist eine sich schon bei Raumtemperatur zersetzende, farblose Flüssigkeit, die bei Kontakt mit Wasser zu Kieselsäuren und Wasserstoff, mit Luftsauerstoff zu Siliciumdioxid und Wasser unter Selbstentzündung[2] reagiert.[5] Pentasilan ist das Silicium-Analogon zum n-Pentan (C5H12).
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
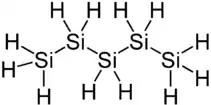 | ||||||||||
| Allgemeines | ||||||||||
| Name | Pentasilan | |||||||||
| Andere Namen |
n-Pentasilan | |||||||||
| Summenformel | Si5H12 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 152,52 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
0,827 g·cm−3 [1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
153,2 °C[3] | |||||||||
| Löslichkeit |
Zersetzung in Wasser [1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Darstellung und Reaktionen
Pentasilan lässt sich aus Hexachlordisilan (Cl3Si–SiCl3) und einer Lewis-Base synthetisieren. Als Lewis-Base kommen z. B. Trimethylamin oder Phosphororganoverbindungen in Frage. In dem stark Lewis-aciden Hexachlordisilan wird die Si-Si-Bindung gespalten unter Freiwerden von Siliciumtetrachlorid (SiCl4) sowie eines basenstabilisierten Silylens (X2Si–R). Die Silylen-Zwischenstufe konnte auch nachgewiesen werden, so dass der Reaktionsmechanismus bestätigt wurde.[6]
Beim Bestrahlen von in 2,3-Dimethylbutan gelöstem Pentasilan mit UV-Licht entstehen höhere Homologe wie das 3-Silylhexasilan und 4-Silylheptasilan.[7]
Neuere Untersuchungen legen die Verwendung höherer, flüssiger Silane wie Pentasilan als nichttoxische Additive zu Raketentreibstoffen nahe, da damit die Verbrennungseffizienz gesteigert werden kann.[2]
Einzelnachweise
- David R. Lide: CRC Handbook of Chemistry and Physics. 87. Auflage, CRC Press, 1998, ISBN 9780849305948, S. 4–87.
- Bernhard Hidding: Untersuchung der Eignung von Silanen als Treibstoffe in der Luft- und Raumfahrt. (PDF; 4,5 MB) (Memento vom 4. März 2016 im Internet Archive) Diplomarbeit an der Universität der Bundeswehr München und der Heinrich-Heine-Universität Düsseldorf, Januar 2004
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 485.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 940–941.
- Meyer-Wegner, F.; Nadj, A.; Bolte, M.; Auner, N.; Wagner, M.; Holthausen, M. C.; Lerner, H.-W.: The Perchlorinated Silanes Si2Cl6 and Si3Cl8 as Sources of SiCl2 In: Chemistry- A European Journal Nr. 17, 2011, S. 4715–4719, doi:10.1002/chem.201003654.
- F. Fehéar, I. Fischer: Beiträge zur Chemie des Siliciums und Germaniums. XXX [1]. Die photochemische Disproportionierung von iso- und n-Pentasilan. Darstellung einiger neuer verzweigter Hepta- und Octasilane. In: ZAAC 1980, 466, 23–28, doi:10.1002/zaac.19804660103.