Paraspeckle
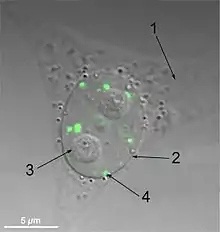
Paraspeckles sind unregelmäßig geformte, membranlose Körper in Zellkernen. Sie haben einen Durchmesser von ca. 0,2–1 µm. Pro Zellkern kann es etwa 2–20 Paraspeckles geben, abhängig vom Zelltyp.[1][2] Ihr Name leitet sich von ihrer Verteilung im Kern ab; "para" steht für parallel und "speckle" bezieht sich auf die Nuclear Speckles, die immer in unmittelbarer Nähe aufzufinden sind.[3]
Paraspeckles sind entscheidend für die Kontrolle der Genexpression durch das Aufbewahren von Proteinen und RNA. Durch diesen Mechanismus als "molekularer Schwamm" können Paraspeckles und ihre Komponenten eine Rolle bei der Kontrolle der Genexpression während vieler zellulärer Prozesse wie Differenzierung, Virusinfektion und Stressreaktionen spielen.[2][4]
Sie bilden sich auf Basis einer langen, nicht kodierenden RNA, die als NEAT1 bezeichnet wird.[3] Durch eine Reihe von Studien wurden ihre molekularen Komponenten, die inneren Strukturen sowie deren zelluläre und physiologische Funktionen charakterisiert. Hinweise deuten darauf hin, dass die Bildung von Paraspeckles durch Phasentrennung von RNA-bindenden Proteinen hervorgerufen wird. Diese enthalten ungeordnete Regionen, durch die eine geordnete Anordnung von Paraspeckle-Komponenten entlang der NEAT1-RNA vermittelt wird.[4]
Paraspeckles existieren nicht in humanen embryonalen Stammzellen, sondern bilden sich erst nach deren Differenzierung. Mäuse, bei keine NEAT1-RNA bilden können, sind unter Laborwachstumsbedingungen lebensfähig, so dass Paraspeckles als nicht essentielle Nukleärkörper betrachtet werden. Sie werden bei bestimmten Umweltauslösern wie Virusinfektion, Proteasomhemmung und Differenzierung gebildet.[3] Paraspeckles sind auf Zellkerne von Säugetieren beschränkt.[5]
Entdeckung
Paraspeckles wurden 2002 durch eine Studie von Proteinen in menschlichen Kernkörperchen (Nucleolus) entdeckt. Durch eine proteomische Analyse von gereinigten menschlichen Nucleoli mithilfe der Massenspektrometrie wurde festgestellt, dass etwa 30 % neuartige Proteine waren. Weitere Analysen an einem dieser neu identifizierten Proteine zeigten, dass sie nicht in Nucleoli angereichert waren, wie erwartet, sondern diffus innerhalb des Karyoplasma verteilt waren. Sie wurden in ca. 5–20 Schwerpunkten im Zellkern konzentriert gefunden. Diese Punkte wurden in der Nähe von der Nuclear Speckles beobachtet und wurden daher als "Paras-Speckles" bezeichnet. Paraspeckles können auch als elektronendichte Strukturen in der Elektronenmikroskopie identifiziert werden.[4]
Das neuartige Protein, das in diesen Strukturen lokalisiert war, wurde später "Paraspeckle Protein 1" (PSPC1) genannt. Sie enthielten zudem ein weiteres Protein namens "NONO". Beide Proteine sind Mitglieder der DHBS (Drosophila brain human splicing)-Familie von RNA-bindenden Proteinen. Bei späteren Untersuchungen wurden zwei weiteren Paraspeckle-Proteine, SFPQ und CFIm68, entdeckt.[2]
Als Zellen mit Medikamenten behandelt wurden, die die Transkription der RNA Polymerase II (Pol II) hemmen, sammelte sich PSPC1 in halbmondförmigen Strukturen an („perinukleoläre Kappe“).[2] Dies wurde auch in der Telophase des Zellzyklus, in der keine Transkription der RNA Polymerase II stattfindet, festgestellt. Hier lösen sich die Paraspeckles auf und ihre Komponenten akkumulieren in den Nukleoli. Dort ordnen sich die Paraspeckles-Proteine halbmondförmig an und bilden die perinukleoläre Kappe.[6][7]
Beteiligte RNA und Proteine
Neben NEAT-RNA enthalten Paraspeckles mehrere RNA-bindende Proteine. Drei davon sind Mitglieder der Drosophila Behavior Human Splicing (DBHS)-Familie - NONO[8] (P54NRB), SFPQ[9] (PSF) und PSPC1[10] (PSP1). Diese DBHS-Proteine scheinen eine Schlüsselrolle für die strukturelle Integrität von Paraspeckles zu spielen: Das Ausschalten der häufig vorhandenen Proteine NONO oder SFPQ in HeLa-Zellen führte zu einem Verlust von Paraspeckles.[2] Die Proteine NONO, PSPC1 und SFPQ teilen sich ca. 50 % ihrer Sequenzabfolge.[7]
Zusätzlich enthalten Paraspeckles auch ca. 40 weitere assoziierte Proteine. Diese Proteine sind an mehreren RNA-Stoffwechselwegen wie die Verarbeitung der RNA und der RNA-Stabilität beteiligt.[3][2] Sie binden sowohl an doppel- als auch an einzelsträngige DNA und RNA.[5] Sie enthalten zwei RNA-bindende Motive an ihrem aminoterminalen Ende.[5]
Das Protein PSPC1 wird am häufigsten als Marker für Paraspeckles verwendet.[2] Darüber hinaus ist die Möglichkeit der RNA-Bindung auch für die Lokalisierung von PSPC1 zu Paraspeckles erforderlich.[7] Die Fähigkeit von PSPC1 mit NONO zu heterodimerisieren ist notwendig, damit es zu Paraspeckles und den perinukleäre Kappen lokalisiert.[7]
Das Protein NONO wurde bei zahlreichen nukleären Ereignissen nachgewiesen, darunter u. a. die Transkriptionsregulation, Spleißen, DNA-Entwicklung, virale RNA-Verarbeitung und Zellproliferation.
Eine weitere für Paraspeckles relevante Funktion ist die Beteiligung von SFPQ- und NONO-Proteinen an der nukleären Einbehaltung von RNA-Molekülen. Diese verhindert, dass eine durch A-zu-I-Edierung verarbeitete RNA den Kern verlässt. Bei diesem Mechanismus wird bis zu der Hälfte aller Adenosine (A) in der RNA in Inosine (I) umgewandelt. Dies tritt meist bei doppelsträngigen RNA-Molekülen auf, die in ihrer Nukleotidsequenz umgekehrte Wiederholungen (inverted repeats) enthalten. Mit dem, was vermutlich als antiviraler Mechanismus entstanden ist, kann die resultierende inosinhaltige RNA im Kern gehalten werden, anstatt in das Cytoplasma exportiert zu werden.[5][2][7]
Durch ihre Rolle in Prozessen wie Spleißen und Transkription sind die biologischen Auswirkungen der DBHS-Proteine weitreichend. Ein weiteres Beispiel zeigt eine konservierte Rolle von NONO bei Säugetieren bei der Kontrolle des circadianen Rhythmus. NONO wird für die Aufrechterhaltung des circadianen Rhythmus von Säugetieren durch Assoziation mit dem PERIOD-1-Protein benötigt.[5][2] DBHS-Proteine erfüllen wahrscheinlich ihre vielfältigen Funktionen, indem sie ihre Bindungspartner variieren, posttranslationale Modifikationen sowie subzelluläre und subnukleäre Lokalisationen durchführen.[5]
Paraspeckle RNA
Nach der ersten Entdeckung von Paraspeckles deuteten mehrere Beobachtungen darauf hin, dass Paraspeckles neben Proteinen auch RNA enthalten. Es wurden zwei Arten von RNAs identifiziert, die spezifisch für Paraspeckles sind und jeweils Hinweise deren Bildung und Funktion liefern.[5]
Ctn: Rolle der Paraspeckles bei der nukleären Einbehaltung der RNA
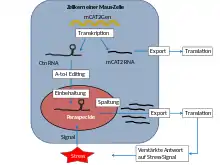
Die Entdeckung der ersten Paraspeckle-RNA in der Maus zeigte, wie diese RNAs an der Kontrolle der Genexpression beteiligt sind, indem sie die RNA im Zellkern einbehalten.[5] Die Ctn RNA der Maus ist ein alternatives Transkript, das aus dem mCAT2-Gen generiert wird.[2] Sie ist 8 kb lang und ist Teil einer antiviralen Reaktion. Neben seiner homogenen Verteilung im Karyoplasma lokalisiert es auch zu Paraspeckles.[3]
Ctn unterscheidet sich von der mCAT2 mRNA dadurch, dass sie einen anderen Promotor verwendet und an ihrem 3' Ende eine viel längere unübersetzte Region (UTR) enthält. Beide RNA-Varianten verhalten sich gegensätzlich: mCAT2 wird aus dem Kern exportiert und normal übersetzt. Ctn verbleibt jedoch im Kern und in den Paraspeckles einiger Zelltypen. Der Schlüssel zur Einbehaltung dieser RNA in den Paraspeckles liegt in der langen 3′ UTR-Region von Ctn. Diese enthält doppelsträngige RNA-Haarnadelstrukturen, die durch das A-zu-I-Edierung verändert wurden.[5] Erst durch eine Reaktion auf Stresssignale wird die lange 3′ UTR von Ctn abgespalten.[5] Dann wird die Ctn-RNA ins Cytoplasma exportiert und dort von den Ribosomen übersetzt.
Das Spaltungsereignis ist mit einem gleichzeitigen Anstieg der kürzeren mCAT2 mRNA im Cytoplasma und einer erhöhten Proteinproduktion verbunden. Da das mCAT2-Protein die Aufnahme von Vorläufern im NO-Reaktionsweg vermittelt, ermöglicht dieser Freisetzungsmechanismus der Zelle, schnell eine NO-Reaktion auf eine Stresssituation zu aktivieren.[5]
Obwohl Ctn beim Menschen nicht vorhanden ist, liefert dies Hinweise darauf, dass nukleäre Retention der RNA weit verbreitet ist, da bis zur Hälfte der menschlichen Transkripte erweiterte UTRs haben könnten. Eine bioinformatische Studie hat gezeigt, dass viele hundert menschliche Transkripte mit invertierten Wiederholungen auch in einer kürzeren Form vorliegen, in der die invertierten Wiederholungen entfernt wurden. Dies deutet darauf hin, dass die Entfernung von invertierten Wiederholungen im Allgemeinen als Mechanismus für die Freigabe von Transkripten aus der nukleären Speicherung verwendet werden kann.[5]
NEAT1: eine lange nichtcodierende RNA in Paraspeckles
Eine lange nicht kodierende RNA (long non-coding RNA, lncRNA) namens NEAT1 fungiert als Gerüst für Paraspeckles, indem sie viele RNA-bindende Proteine rekrutiert, die an Entwicklung, Krebs und Neurodegeneration beteiligt sind.[11] NEAT1 ist für die Bildung und Aufrechterhaltung von Paraspeckles unerlässlich: Sie formieren sich in Abwesenheit von NEAT1 nach vorübergehender Transkriptionshemmung nicht erneut, und das Ausschalten des NEAT1-Gens führt zum Verlust von Paraspeckles.[5]
Gene, die für NEAT1 und MALAT1 kodieren, befinden sich typischerweise dicht beieinander in Säugetiergenomen, etwas entfernt vom nächsten Protein kodierenden Gen. Sie sind beide im Zellkern angereicherte ncRNA (nichtcodierende RNA). Ein weiteres Merkmal von NEAT1 und MALAT1 ist, dass die langen RNAs, die von jedem Gen transkribiert werden, beide an ihren 3′-Enden gespalten werden, um ein ungewöhnliches kleines tRNA-ähnliches Molekül zu produzieren. Dies könnte ein Markenzeichen einiger nukleärer ncRNAs sein.[5] Bei beiden dieser ncRNAs wurde nachgewiesen, dass sie zu bestimmten Orten im Zellkern lokalisieren, MALAT1 innerhalb von Nuclear Speckles und NEAT1 an Orten, die an angrenzenden Nuclear Speckles liegen.[5] Bei NEAT1 wurde nachwiesen, dass sie in Paraspeckles lokalisieren und dass die NEAT1-RNA zudem für die Integrität der Paraspeckles unerlässlich ist.[5]
Zwei Isoformen von NEAT1 werden transkribiert, NEAT1_v1 und NEAT1_v2 (auch bekannt als MEN-ϵ und MEN-β). Sie überlappen sich in ca. 3–4 kb ihrer Sequenz auf der 5'-Seite. Beide Transkripte lokalisieren in Paraspeckles in Maus- und menschlichen Zellen. Die Beschränkung von NEAT1 auf Paraspeckles ist größer als bei DBHS-Proteinen wie NONO, das ebenfalls im Karyoplasma reichlich vorhanden ist. NEAT1_v2 wird durch spezielle Triple-Helix-Strukturen stabilisiert.[4] NEAT1_v2 bildet den Paraspeckle-Kern, während NEAT1_v1 als Nebenfaktor verwendet wird.[3][1] Während sich auch andere Proteinkomponenten von Paraspeckles diffus im gesamten Karyoplasma befinden, kommt die NEAT1-RNA fast ausschließlich in Paraspeckles vor.[1]
NEAT1 dient wahrscheinlich auch als Keimbildungsfaktor von Paraspeckles. Es wurde beobachtet, wie sich Paraspeckles in der frühen G1-Phase des Zellzyklus in der Nähe des NEAT1-Gens bilden. Sie kommen oft in der Nähe des NEAT1-Gens in der Interphase gebündelt vor.[5] Wie Ctn assoziiert NEAT1 mit DBHS-Proteinen.[5] Wie bei Ctn scheint es, dass die Interaktion mit DBHS-Proteinen eine Rolle bei der NEAT1-Paraspeckle-Lokalisierung spielt.[2] Im Gegensatz zu Ctn zeigt NEAT1 keine Hinweise auf A-zu-I-Edierung. Dies deutet darauf hin, dass die DBHS-Proteine mehr als einen Modus der RNA-Bindung innerhalb von Paraspeckles verwenden. Das Vorhandensein nur sehr sporadischer kurzer Erhaltungsregionen zwischen NEAT1-Sequenzen von Säugetieren erhöht die Möglichkeit, dass DBHS-Proteine eher an eine RNA-Struktur als eine Sequenz binden.[5] Eine frühere Studie über die Bindung von DBHS-Proteinen an U5SnRNA unterstützt jedoch sowohl sequenz- als auch strukturbasierte Aspekte der Bindung.[5]
Struktur und Aufbau
Paraspeckles sind kleine, unregelmäßige und ungleichmäßig verteilte subnukleäre Körper. EM-Studien und Fluoreszenzbilder zeigen einen Paraspeckle-Größenbereich von 0,5–1 µm im Durchmesser und eine unregelmäßige, wurstähnliche Form.[2] Bisher sind Paraspeckles nur in Säugetierzellen zu finden. Innerhalb von Säugetiergeweben und -zellen sind Paraspeckles weit verbreitet: Die Mehrheit der untersuchten Zelllinien und Geweben von Maus und Mensch enthält Paraspeckles.[2] Sie werden im Interchromatin-Raum beobachtet und sind zwischen den größeren Nuclear Speckles und Chromatin quasi eingeklemmt.[2] Die funktionelle Beziehung zwischen Paraspeckles und dem Nucleolus ist noch nicht vollständig geklärt.[2] In-situ-Elektronenmikroskopie-Analysen ergaben, dass sich 5′ und 3′ Endbereiche von NEAT1_2 im Randbereich von Paraspeckles befinden, während sich zentrale Bereiche von NEAT1_2 im Kern befinden.[4]
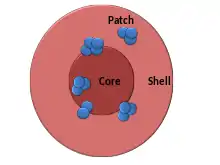
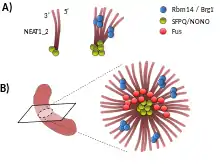
Paraspeckles bestehen aus mehreren Komponenten, die sich in drei Gruppen einteilen lassen: Kern-, Schalen- und Patch-Komponenten. Die Schale besteht aus den Regionen 5′ und 3′ von NEAT1_2, Tardbp-Molekülen (TDP-43) und purinreichen RNAs. NEAT1_1, die kürzere Isoform von NEAT1, befindet sich ebenfalls in der Hülle. In der Schale vermischen sich die Bereiche 5′ und 3′ von NEAT_2 nicht und werden als diskrete Punkte beobachtet, was darauf hindeutet, dass sie unabhängig voneinander gebündelt sind. Die Kernregion der Paraspeckles besteht aus den RNA-bindenden Proteinen der DBHS-Familie (Sfpq, NONO und PSPC1) und Fus, sowie der mittleren Region von NEAT1_2-RNAs. Die Patch-Komponenten beinhalten Rbm14- und Brg1-Proteine. Sie bilden mehrere kleinere Patches, die sich sowohl in der Hülle als auch im Kern der Paraspeckles verteilen. Die Untergliederung der Paraspeckles in eine Kern-Schale-Struktur könnte dabei helfen, dass die Kernkomponenten im Karyoplasma von den anderen Komponenten getrennt sind und somit durch die Sequestrierung funktionell inaktiviert werden. Darüber hinaus können die Kernkomponenten eine aktive Rolle bei der Aufrechterhaltung der strukturellen Integrität des Paraspeckle spielen. Komponenten der Schale könnten aber auch eine Plattform für bestimmte molekulare Prozesse bieten, die an der Peripherie von Paraspeckles stattfinden[4]
Bildung
Nach der Bildung von Paraspeckles bleiben diese während des Zellzyklus weitgehend unverändert und verschwinden erst, wenn sich in der Telophase Tochterkerne bilden. Untersuchungen zeigen, dass die Paraspeckles während der Interphase und während der Zeit der Mitose, einschließlich Prophase, Metaphase und Anaphase, bestehen bleiben.[7] Die Bildung von Paraspeckles wird nach der Zellteilung eingeleitet. Sobald sich Paraspeckles gebildet haben, bleiben sie während des Zellzyklus stabil und bestehen in der Mitose bis zur Anaphase, wenn sie sich über die Zelle verteilen.[1] Die Bildung einzelner Paraspeckles beginnt in der frühen G1-Phase bis ca. 1 Stunde nach Beginn der RNA-Transkription.[1]
Die Bildung der Paraspeckles könnte wie folgt vor sich gehen: Nach der Zellteilung beginnt die Produktion von NEAT1 in den Tochterkernen.[5] Bevor NEAT1 die Chance hat, sich von seinem Genort zu lösen, wird es schnell von DBHS-Proteindimeren aufgegriffen. Zusammen baut dieser RNA-Protein-Komplex das Paraspeckle-Partikel auf. Der fertige Paraspeckle besteht wahrscheinlich aus mehreren Kopien von NEAT1 RNA-DBHS-Proteinkomplexen. Diese bilden ein strukturelles Gerüst, das dennoch dynamisch ist: Einzelne DBHS-Proteinmoleküle können über das Karyoplasma ausgetauscht werden.[5]
Ohne die Produktion von NEAT1 RNA bilden sich keine Paraspeckles. Dies erklärt, weshalb Paraspeckles nicht beobachtet werden, wenn die Pol-II-Transkription gehemmt wird, weder in Zelltypen, die NEAT1 nicht exprimieren, noch in Organismen, die das NEAT1-Gen nicht enthalten. Umgekehrt werden ohne reichlich vorhandene DBHS-Proteine auch keine Paraspeckles beobachtet.
Die ersten Paraspeckles bilden sich sehr nah am NEAT1-Genlocus, und auch die Paraspeckles bleiben in der Interphase eng mit dem NEAT1-Gen verbunden; wie die Assoziation erhalten bleibt, ist jedoch nicht bekannt.[5]
Schritte:
a) Die Paraspeckle-Bildung beginnt mit der Produktion von NEAT1-Transkripten in Tochterkernen nach der Zellteilung.[2]
b) Nach der Transkription bilden NEAT1-Moleküle Komplexe mit DBHS-Proteinen, im Allgemeinen bevor die RNA die Möglichkeit hatte, weit weg von ihrem Genort zu diffundieren.[2] An einem bestimmten Punkt verursachen gegenseitige Wechselwirkungen dieser Elemente entlang der Grundeinheiten einen Phasenübergang. Dieser führt zur Bildung von kugelförmigen Paraspeckles mit radial angeordneten V-förmigen NEAT1-Basiseinheiten.[4] Der Phasenübergang sollte nicht durch eine einfache Erhöhung der Konzentration von Paraspeckle-Proteinen ausgelöst werden, sondern durch eine spezifische Interaktion und/oder räumliche Anordnung jeder Komponente, die der Bildung der geordneten Kern-Schale-Konstruktion mit einem unterschiedlichen Durchmesser zugrunde liegen kann.[4]
c) Der fertige Paraspeckle besteht wahrscheinlich aus mehreren Kopien von NEAT1 RNA-DBHS-Proteinkomplexen, die ein strukturelles Gerüst bilden, das dennoch dynamisch ist, indem einzelne DBHS-Proteinmoleküle in Paraspeckles mit einem Pool von DBHS-Proteinen im Karyoplasma ausgetauscht werden können.
Funktion
Eine Studie von 2009 (L.L.Chen, G.G.Carmichael[13]) vereint die Beiträge der drei Haupttypen von Protein- und RNA-Molekülen innerhalb von Paraspeckles in einem wichtigen Bereich der Zellbiologie: Pluripotenz und Differenzierung. In dieser Studie ziehen die Autoren den Schluss, dass die Bildung von Paraspeckles mit einem Verlust der Pluripotenz in embryonalen Stammzellen verbunden ist. Darüber hinaus legen sie nahe, dass ein Mangel an NEAT1 und Paraspeckles als Marker für Pluripotenz genutzt werden kann. Paraspeckles tragen höchstwahrscheinlich zur Differenzierung bei, indem sie das Genexpressionsprofil durch nukleäre Einbehaltung von A-zu-I-edierter mRNA verändern.[5]
Auf molekularer Ebene wurde festgestellt, dass Paraspeckles Proteine und RNA sequestrieren können, um ihr Verhalten außerhalb der Paraspeckles zu modulieren und so als molekularer Schwamm zu fungieren[4] Sie scheinen aktiv eine Plattform für die Zusammenstellung von molekularen Komponenten zu bieten, die für bestimmte molekulare Prozesse erforderlich sind.[4] Der RNA-Einbehaltungsmechanismus kann an vielen zellulären Prozessen wie Stressreaktionen, Virusinfektionen und der Aufrechterhaltung des zirkadianen Rhythmus beteiligt sein.[2]
Vielleicht am wichtigsten, angesichts der Verbindung zwischen Paraspeckles und verschiedenen Differenzierungsmodellen, ist es wahrscheinlich, dass Paraspeckles eine Rolle bei der Umprogrammierung einer Zelle spielen, die mit der Differenzierung stattfindet, möglicherweise durch eine Änderung der Expression von Schlüsselproteinen über die Speicherung von RNA im Kern.[2]
Eine weitere mögliche Rolle für Paraspeckle in der Zellbiologie spielt die Reaktion auf bestimmte Viren. Eine frühere Studie berichtete, dass VINC-1 (dies entspricht nachweislich NEAT1) im zentralen Nervensystem von Mäusen nach einer Infektion mit Japanischen Enzephalitis oder Tollwutviren hochreguliert wird. Mehrere Studien haben einen Zusammenhang zwischen der Hochregulierung der NEAT1-Herstellung und der Paraspeckle-Bildung nachgewiesen. So ist es möglich, dass diese Viren eine Zunahme der Größe und Anzahl der Paraspeckles auslösen können, z. B. als zellulärer Abwehrmechanismus.[5]
Einzelnachweise
- M. Dundr, T. Misteli: Biogenesis of Nuclear Bodies. In: Cold Spring Harbor Perspectives in Biology. Band 2, Nr. 12, 1. Dezember 2010, ISSN 1943-0264, S. a000711–a000711, doi:10.1101/cshperspect.a000711, PMID 21068152, PMC 2982170 (freier Volltext).
- A. H. Fox, A. I. Lamond: Paraspeckles. In: Cold Spring Harbor Perspectives in Biology. Band 2, Nr. 7, 1. Juli 2010, ISSN 1943-0264, S. a000687–a000687, doi:10.1101/cshperspect.a000687, PMID 20573717, PMC 2890200 (freier Volltext).
- Kannanganattu V. Prasanth, Supriya G. Prasanth, Michael F. Jantsch, Tetsuro Hirose, Shinichi Nakagawa: Paraspeckles modulate the intranuclear distribution of paraspeckle-associated Ctn RNA. In: Scientific Reports. Band 6, 26. September 2016, ISSN 2045-2322, S. 34043, doi:10.1038/srep34043, PMID 27665741, PMC 5036046 (freier Volltext).
- Shinichi Nakagawa, Tomohiro Yamazaki, Tetsuro Hirose: Molecular dissection of nuclear paraspeckles: towards understanding the emerging world of the RNP milieu. In: Open Biology. Band 8, Nr. 10, Oktober 2018, ISSN 2046-2441, S. 180150, doi:10.1098/rsob.180150, PMID 30355755, PMC 6223218 (freier Volltext).
- Charles S. Bond, Archa H. Fox: Paraspeckles: nuclear bodies built on long noncoding RNA. In: The Journal of Cell Biology. Band 186, Nr. 5, 7. September 2009, ISSN 0021-9525, S. 637–644, doi:10.1083/jcb.200906113 (Online [abgerufen am 8. Juni 2019]).
- Jasmin Speil: Intrazelluläre Dynamik des Transkriptionsfaktors STAT1. Dissertation. Bonn 2010, urn:nbn:de:hbz:5N-22328.
- Archa H. Fox, Charles S. Bond, Angus I. Lamond: P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner. In: Molecular Biology of the Cell. Band 16, Nr. 11, November 2005, ISSN 1059-1524, S. 5304–5315, doi:10.1091/mbc.e05-06-0587, PMID 16148043, PMC 1266428 (freier Volltext).
- NONO non-POU domain containing octamer binding [ Homo sapiens (human) ]. Abgerufen am 8. Juni 2019.
- SFPQ splicing factor proline and glutamine rich [ Homo sapiens (human) ]. Abgerufen am 8. Juni 2019.
- PSPC1 paraspeckle component 1 [ Homo sapiens (human) ]. Abgerufen am 8. Juni 2019.
- Miha Modic, Markus Grosch, Gregor Rot, Silvia Schirge, Tjasa Lepko: Cross-Regulation between TDP-43 and Paraspeckles Promotes Pluripotency-Differentiation Transition. In: Molecular Cell. Band 74, Nr. 5, Juni 2019, S. 951–965.e13, doi:10.1016/j.molcel.2019.03.041 (Online [abgerufen am 8. Juni 2019]).
- Shinichi Nakagawa, Tetsuro Hirose: Paraspeckle nuclear bodies—useful uselessness? In: Cellular and Molecular Life Sciences. Band 69, Nr. 18, September 2012, ISSN 1420-682X, S. 3027–3036, doi:10.1007/s00018-012-0973-x (Online [abgerufen am 8. Juni 2019]).
- Ling-Ling Chen, Gordon G. Carmichael: Altered Nuclear Retention of mRNAs Containing Inverted Repeats in Human Embryonic Stem Cells: Functional Role of a Nuclear Noncoding RNA. In: Molecular Cell. Band 35, Nr. 4, August 2009, S. 467–478, doi:10.1016/j.molcel.2009.06.027 (Online [abgerufen am 8. Juni 2019]).