Pacmanvirus
Die vorgeschlagene Viren-Gattung „Pacmanvirus“ mit der einzigen Spezies „Pacmanvirus A23“ beinhaltet Riesenviren des Phylums Nucleocytoviricota (früher Nucleocytoplasmic large DN viruses, NCLDV). Sie ist morphologisch und genetisch ähnlich zwei anderen vorgeschlagenen Vertretern der Riesenviren, dem „Faustovirus“ und dem „Kaumoebavirus“, sowie den Viren der Familie Asfarviridae mit der Spezies Asfivirus (ASFV), dem Erreger der Afrikanischen Schweinepest. Die Pacmanviren erhielten ihren Namen aufgrund ihrer Kapsidform, die bei einer negativen Färbung im Elektronenmikroskop beobachtet wird: Sie ähnelt der Spielfigur des gleichnamigen Videospiels Pac-Man.[4]
| „Pacmanvirus“ | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
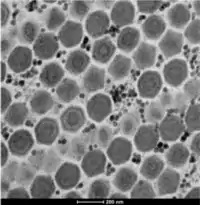
EM-Aufnahme: Wabenstruktur der Virusfabrik von „Pacmanvirus A23“ in A. castellanii. Maßstab 200 nm | ||||||||||||||||
| Systematik | ||||||||||||||||
| ||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||
| ||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||
| „Pacmanvirus“ | ||||||||||||||||
| Links | ||||||||||||||||
|
Pacmanviren wurden erstmals im Jahr 2017 durch die gemeinsame Kultivierung von Amöben der Spezies Acanthamoeba castellanii mit verschiedenen Umweltproben aus Algerien nachgewiesen.[5]
Bisher (Stand Juli 2019) ist die vorgeschlagene Gattung „Pacmanvirus“ noch nicht in der Datenbank des International Committee on Taxonomy of Viruses (ICTV) registriert.[6]
Aufbau
Die Kapside der Virusteilchen (Virionen) von „Pacmanvirus“ haben eine ikosaedrische, aber leicht unregelmäßige Form (woher es seinem Namen verdankt) und erreichen eine Größe von etwa 175 nm, wobei die innere Membran des Virus die Geometrie des Kapsids wiederholt. Das Genom von „Pacmanvirus“ ist ein doppelsträngiges DNA-Molekül (dsDNS), mit einer Länge von 395.405 bp. Der GC-Gehalt des Genoms liegt bei 33,6 % und damit unter dem der verwandten Viren. Das DNA-Genom ist höchstwahrscheinlich nicht zirkulär, sondern linear. Dem Genom fehlen vollständig große Wiederholungen (englisch large repeats) oder invertierte Regionen (englisch inverted regions). Es wurde auch ein tRNA-Gen (das Isoleucin-tRNA-Gen), gefunden, obwohl verwandte Viren keine tRNA-Gene enthalten. Entsprechend den bioinformatischen Daten sollte das Genom 465 Gene kodieren. 135 von ihnen sind mit den Genen anderer Viren verwandt, 45 mit den Genen von Eukaryoten, 41 mit den Genen von Prokaryoten (und zwar 38 Bakteriengene und 3 Archaeengene). Nach der Analyse des Genrepertoires ist der nächste bisher bekannte Verwandte des „Pacmanvirus“ das bisher ebenfalls nur vorgeschlagene „Faustovirus“ (ebenfalls ein Riesenvirus). Gemeinsame Gene mit anderen (z. T. ebenfalls vorgeschlagenen) Virusgattungen:
- 84 mit „Faustovirus“
- 9 mit dem ebenfalls verwandten „Kaumoebavirus“
- 11 mit Marseillevirus
- 9 mit Mimivirus
- nur 2 mit Viren der Familie Asfarviridae.
Bei 3 Genen besteht Ähnlichkeiten (Homologie) zu entsprechenden von Acanthamoeba castellanii und bei 4 Genen zu Schleimpilzen der Gattung Dictyostelium. 244 Gene haben keine bekannten Homologe und nur 155 Gene haben eine funktionelle Annotation.[5]
Vermehrungszyklus
Im Vergleich zum Mimivirus vermehrt sich das „Pacmanvirus“ im gleichen Wirt, den Amöbenzellen von Acanthamoeba castellanii extrem schnell. Die ersten geschädigten Zellen treten 6 Stunden nach der Infektion auf, und nach weiteren zwei Stunden erfolgt eine vollständige Lyse der Amöbenzellen. Bereits 15 Minuten nach dem Kontakt des Virions mit einer Amöbenzelle sind Viruspartikel in Phagozytose-vakuolen nachweisbar und dann auch im Zytoplasma der Zelle, allerdings ohne Öffnung des Kapsids. Höchstwahrscheinlich interagieren Viren mit den im Zytoplasma befindlichen Mitochondrien, eine Membranfusion findet jedoch nicht statt. Obwohl leere Kapside im Cytoplasma nachgewiesen wurden, konnte die Freisetzung von DNA aus dem Kapsid bisher nicht beobachtet werden. 3 Stunden nach der Infektion erscheinen in den Wirtszellen gut ausgebildete Virusfabriken, aber die neu gebildeten Virionen werden erst 4 Stunden nach der Infektion sichtbar. Nach 6 Stunden füllt sich die Amöbenzelle mit Viruspartikeln, die manchmal sogar Cluster von regelmäßiger geometrischer Form bilden – in der gesamten Zelle oder in Teilen davon am Rand der Virusfabrik. 8 Stunden nach dem Eintritt des Virus in die Zelle kommt es schließlich zur Lysis.[5]
Eine Vermehrung von „Pacmanvirus“ in Amöben der Spezies Vermamoeba vermiformis oder Dictyostelium discoideum war nicht möglich.[5]
Systematik
Auf Basis der Gensequenz von Genen der DNA-Polymerase-B-Familie bilden „Pacmanvirus“, „Kaumoebavirus“, „Faustovirus“ und die Asfarviridae einen phylogenetischen Baum (Klade), offenbar hatten diese Viren einen gemeinsamen Vorfahren. In Bezug auf die Kapsid-Architektur steht „Pacmanvirus“ dem „Faustovirus“ am nächsten.[5]
Die meisten Autoren schlagen vor, die Gattung Faustovirus als Prototyp einer neuen Familie Faustoviridae[2] innerhalb der Nucleocytoplasmic large DNA viruses (NCLDV, vom ICTV im März neu eingerichtetes Phylum Nucleocytoviricota)[1] aufzufassen, die der Familie Asfarviridae mit Gattung Asfivirus (ASFV) nahesteht, aber von ihr immer noch verschieden ist.[7][8][9] Das ICTV hat im März für die nähere Verwandtschaft der Asfarviridae die neue Ordnung Asfuvirales eingerichtet, womit ein Taxon für die gemeinsame Klade der Asfaviridae und „Faustoviridae“ zur Verfügung steht. Schulz et al (2018) schlagen für diese Klade eine Systematik wie folgt vor:[3]
| Asfuvirales[1] |
| ||||||||||||||||||
Im Vergleich dazu sehen Guglielmini et al. (2019), Fig. 2, die Positionen von Asfarviridae und „Kaumoebavirus“ vertauscht.[10] Als mögliches weiteres Mitglied dieser erweiterten Asfarviridae-Gruppe wurde das Dinodnavirus vorgeschlagen.[11]
Weblinks
- Pacmanvirus A23 im National Center for Biotechnology Information (NCBI); abgerufen am 7. Juli 2019.
- Taxonomy - Pacmanvirus A23 SPECIES. UniProt; abgerufen am 7. Juli 2019.
- dsDNA Viruses > Asfarviridae ICTV Report vom März 2018, Fig. 4
- Pierre-Philippe Dechant: Recent developments in mathematical virology. (PDF) ICERM, York St. John University, 15. November 2018
- Lillian Steenblik Hwang: Analyze This: These viruses are behemoths, auf: ScienceNews for Students vom 13. Juni 2018. Mit Bild und Größenvergleich.
 CC BY 2.5.
CC BY 2.5.
Einzelnachweise
- ICTV: ICTV Master Species List 2019.v1, New MSL including all taxa updates since the 2018b release, March 2020 (MSL #35)
- Leena H. Bajrai, Samia Benamar, Esam I. Azhar, Catherine Robert, Anthony Levasseur, Didier Raoult, Bernard La Scola; Eric O. Freed (Hrsg.): Kaumoebavirus, a New Virus That Clusters with Faustoviruses and Asfarviridae. In: VirusesVolume 8, Nr. 11, 28. Oktober 2016, S. 278, doi: 10.3390/v8110278, PMC 5127008 (freier Volltext), PMID 27801826
- Frederik Schulz, Lauren Alteio, Danielle Goudeau, Elizabeth M. Ryan, Feiqiao B. Yu, Rex R. Malmstrom, Jeffrey Blanchard, Tanja Woyke: Hidden diversity of soil giant viruses, in: Nature Communicationsvolume 9, Article number: 4881 (2018) vom 19. November 2018, doi:10.1038/s41467-018-07335-2
- Colson Philippe, La Scola Bernard, Raoult Didier: Giant Viruses of Amoebae: A Journey Through Innovative Research and Paradigm Changes. In: Annual Review of Virology,, Volume 4, Nr. 1, 29. September 2017, S. 61–85, doi:10.1146/annurev-virology-101416-041816, ISSN 2327-056X
- J. Andreani, J. Y. B. Khalil, M. Sevvana, S. Benamar, F. Di Pinto, I. Bitam, P. Colson, T. Klose, M. G. Rossmann, D. Raoult, B. La Scola: Pacmanvirus, a New Giant Icosahedral Virus at the Crossroads between Asfarviridae and Faustoviruses. In: Journal Of Virology, 26. Juni 2017, 91(14). pii: e00212-17. Print 15. Juli 2017. doi:10.1128/JVI.00212-17, PMID 28446673
- Suche Pacmanvirus in der ICTV Datenbank. Abgerufen am 7. Juli 2019.
- D. G. Reteno, S. Benamar, J. Y B. Khalil, J. Andreani, N. Armstrong, T. Klose, M. Rossmann, P. Colson, D. Raoult, B. La Scola: Faustovirus, an asfarvirus-related new lineage of giant viruses infecting amoebae. In: Journal of virology. Band 89, Nummer 13, Juli 2015, S. 6585–6594, doi:10.1128/JVI.00115-15, PMID 25878099, PMC 4468488 (freier Volltext).
- S. Benamar, D. G. Reteno, V. Bandaly, N. Labas, D. Raoult, B. La Scola: Faustoviruses: Comparative Genomics of New Megavirales Family Members. In: Frontiers in microbiology. Band 7, 2016, S. 3, doi:10.3389/fmicb.2016.00003, PMID 26903952, PMC 4742530 (freier Volltext).
- T. Klose, D. G. Reteno, S. Benamar, A. Hollerbach, P. Colson, B. La Scola, M. G. Rossmann: Structure of faustovirus, a large dsDNA virus. In: Proceedings of the National Academy of Sciences. Band 113, Nummer 22, Mai 2016, S. 6206–6211, doi:10.1073/pnas.1523999113, PMID 27185929, PMC 4896704 (freier Volltext).
- Julien Guglielmini, Anthony C. Woo, Mart Krupovic, Patrick Forterre, Morgan Gaia: Diversification of giant and large eukaryotic dsDNnA viruses predated the origin of modern eukaryotes, in: PNAS, Band 116, Nr. 39, 10./24. September 2019, S. 19585–19592, doi:10.1073/pnas.1912006116, PMID 31506349, Fig. 2
- H. Ogata, K. Toyoda, Y. Tomaru, N. Nakayama, Y. Shirai, J. M. Claverie, K. Nagasaki: Remarkable sequence similarity between the dinoflagellate-infecting marine girus and the terrestrial pathogen African swine fever virus. In: Virol J., 6, 2009, S. 178.