Asfarviridae
Als Asfarviridae bezeichnet man eine Familie von Viren, deren Mitglieder vornehmlich Schweine infizieren und die Afrikanische Schweinepest verursachen. In der Familie existiert nur eine einzige Gattung: Asfivirus (ASFV). Der Name dieses Virus ist ein Akronym: African swine fever and related viruses. Bislang wurde nur eine einzige Spezies identifiziert. Diese Viren sind die einzigen DNA-Viren, die von Arthropoden übertragen werden. Die Viren besitzen alle eine Virushülle, haben eine dsDNA (Doppelstrang-DNA) und werden dem Phylum der Nucleocytoviricota (veraltet Nucleocytoplasmic large DNA viruses, NCLDV; frühere Vorschläge hatten auf Nucleocytoplasmaviricota bzw. – im Rang einer Ordnung – Megavirales gelautet) zugerechnet.[1] Das Asfivirus zeigt in der Genomstruktur und den Replikationsstrategien Ähnlichkeiten mit den Poxviridae und den Phycodnaviridae, hat aber eine von den Poxviridae verschiedene Virionstruktur und noch einige andere Eigenschaften, die es von den Letzteren unterscheidet.[2] Aus diesem Grund wurden die Poxviridae (mit ihrer Ordnung Chitovirales) und die Asfarviridae (mit ihrer Ordnung Asfuvirales) vom International Committee on Taxonomy of Viruses (ICTV) im März 2020 in die gemeinsame, neu geschaffene Klasse Pokkesviricetes gestellt.[1]
| Asfarviridae | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
Asfarviridae | ||||||||||||||||
| Systematik | ||||||||||||||||
| ||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||
| ||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||
| Asfarviridae | ||||||||||||||||
| Links | ||||||||||||||||
|
Struktur und Genom
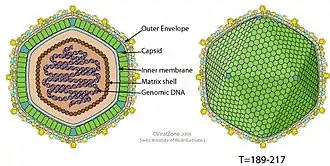
Das Virion besteht aus einer Hülle, einem Kapsid, einem Kern und dem Nukleoproteinkomplex. Diese sind sphärisch und ihr Durchmesser beträgt zwischen 175 und 215 nm. Das Kapsid ist ikosaedrisch (T=189–217) mit einem Durchmesser von 172–191 nm. Das Kapsomer hat einen Durchmesser von 13 nm und 1892 bis 2172 von ihnen bilden ein Kapsid. Das Genom des Virus ist eine lineare, doppelsträngige DNA (ds-DNA) mit einer Länge von 170 und 190 kb. Ihr GC-Gehalt beträgt 39 %.
Vermehrung und Wirt
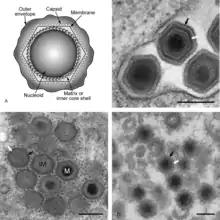
Das Virus kann in Zellkulturen angezüchtet werden, ohne das im Lichtmikroskop Zellveränderungen sichtbar werden. In Gewebebiopsien kann man intrazytoplasmatisch acidophile Einschlusskörperchen sehen, die dem Viroplasma entsprechen. Die Replikation der Viren erfolgt zytoplasmatisch und die Virionen reifen durch Knospung aus Plasmamembranen. Die Viren dieser Familie infizieren Hausschweine und ihre Verwandten. Die natürlichen Wirte der Viren sind Warzenschwein (Phacochoerus africanus) und Flussschwein (Potamochoerus porcus), wobei das Virus durch Lederzecken als Vektor übertragen wird. Infizierte junge Warzenschweine entwickeln eine ausgeprägte Virämie und infizieren die Zecken bei der Blutmahlzeit. Alte Warzenschweine sind aufgrund der hohen Prävalenz häufig bereits immun. Das Virus kann sich in den Zecken vermehren, wo es auch auf die nachfolgende Generation ohne Blutmahlzeit übertragen wird (vertikale, transovarielle Übertragung). Horizontale Übertragungen zwischen adulten Zecken beim Geschlechtsakt sind beschrieben.
Während einer Infektion kann sich das Virus im Wirt in Erythrozyten, Endothelzellen und Leukozyten vermehren, aber nicht in Epithelien. Entsprechend kann das Virus aus Blut, Milzgewebe, Lymphknoten und Tonsillen infizierter Tiere gewonnen werden. Keine der Virusspezies infiziert den Menschen.
Epidemiologie
Das Vorkommen dieser Virusfamilie war ursprünglich auf Afrika beschränkt. Allerdings hat sich das Virus in jüngster Zeit in Südeuropa und Amerika verbreitet.
Systematik
Schulz et al. schlagen folgende Systematik vor:[4]
| Nucleocytoviricota (NCLDV): Pokkesviricetes |
| ||||||||||||||||||||||||
Koonin et al. (2015 und 2019) schlagen eine innere Systematik der NCLDV vor, in der die (erweiterte) Familie der Asfarviridae eine Schwestergruppe der Poxviridae bilden. Zusammen bilden sie dann neben einem einen 3. Zweig (englisch branch) der NCLDV, neben einem 1. Zweig mit Mimiviridae und Phycodnaviridae, und einem 2. Zweig mit den Pithoviridae, Marseilleviridae und Iridoviridae.[5] Diesem Vorschlag ist das ICTV mit seiner Master Species List (MSL) #35 im März 2020 gefolgt, auch wenn Rolland et al. (2019) die Pokkesviricetes innerhalb der NCLDV näher bei der erweiterten Familie der Mimivirdae (d. h. der Ordnung Imitervirales) sahen.[3]
Als weiteres Mitglied dieser erweiterten Asfarviridae-Gruppe wurde das Dinodnavirus vorgeschlagen.[6]
Weblinks
- MeSH Asfarviridae
- dsDNA Viruses > Asfarviridae ICTV Report vom März 2018
- Viralzone: Asfarviridae
Einzelnachweise
- ICTV: ICTV Taxonomy history: African swine fever virus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- Index of Viruses - Asfarviridae (2006). In: ICTVdB - The Universal Virus Database, version 4. C. Büchen-Osmond (Ed.), Columbia University, New York; ncbi.nlm.nih.gov
- Clara Rolland, Julien Andreani, Amina Cherif Louazani, Sarah Aherfi, Rania Francis, Rodrigo Rodrigues, Ludmila Santos Silva, Dehia Sahmi, Said Mougari, Nisrine Chelkha, Meriem Bekliz, Lorena Silva, Felipe Assis, Fábio Dornas, Jacques Yaacoub Bou Khalil, Isabelle Pagnier, Christelle Desnues, Anthony Levasseur, Philippe Colson, Jônatas Abrahão, Bernard La Scola: Discovery and Further Studies on Giant Viruses at the IHU Mediterranee Infection That Modified the Perception of the Virosphere. In: Viruses, Band 11, Nr. 4, doi:10.3390/v11040312. Siehe insbes. Fig. 4A.
- Frederik Schulz, Lauren Alteio, Danielle Goudeau, Elizabeth M. Ryan, Feiqiao B. Yu, Rex R. Malmstrom, Jeffrey Blanchard, Tanja Woyke: Hidden diversity of soil giant viruses. In: Nature Communications, volume 9, Article number: 4881, 19. November 2018, doi:10.1038/s41467-018-07335-2.
- Eugene V. Koonin, Natalya Yutin: Evolution of the Large Nucleocytoplasmatic DNA Viruses of Eukaryotes and Convergent Origins of Viral Gigantism. In: Advances in Virus research, Band 103, AP 21. Januar 2019, S. 167–202, doi:10.1016/bs.aivir.2018.09.002. Die Klosneuviren sind teilweise als Klosneviren fehlgeschrieben.
- H. Ogata, K. Toyoda, Y. Tomaru, N. Nakayama, Y. Shirai, J. M. Claverie, K. Nagasaki: Remarkable sequence similarity between the dinoflagellate-infecting marine girus and the terrestrial pathogen African swine fever virus. In: Virol J., 6, 2009, S. 178.