Orthokohlensäuretetramethylester
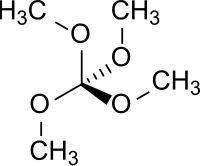
Orthokohlensäuretetramethylester ist eine organische chemische Verbindung aus der Gruppe der Orthokohlensäureester. Sie entsteht formal durch vollständige Methylierung der hypothetischen, d. h. gegen die Erlenmeyer-Regel verstoßenden und in freiem Zustand instabilen Orthokohlensäure . Orthokohlensäuretetramethylester wurde erstmals 1927 dargestellt und als farblose, merklich flüchtige Flüssigkeit von campherartigem Geruch charakterisiert.[1]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Orthokohlensäuretetramethylester | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H12O4 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 136,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
1,023 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
114 °C[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,3864 (18,5 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
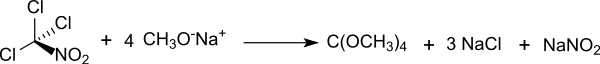
Die ursprüngliche Darstellung des Orthokohlensäuretetramethylesters ging von Chlorpikrin[1] aus, der naheliegende Syntheseweg aus Tetrachlorkohlenstoff liefert nicht das gewünschte Produkt.[3]
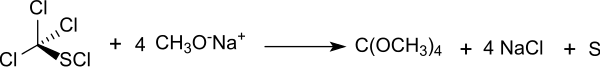
Wegen der unangenehmen Eigenschaften des Chlorpikrins wurden andere tetrasubstituierte reaktive Methanderivate als Ausgangsstoffe für Orthokohlensäuretetramethylester untersucht, so das ebenfalls als chemischer Kampfstoff eingesetzte, einfach aus Schwefelkohlenstoff und Chlor zugängliche Trichlormethansulfenylchlorid[4][5] analog
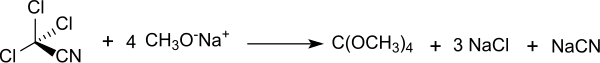
Ein weniger problematischer Syntheseweg geht aus von Trichloracetonitril,[6][7] wobei Ausbeuten um 70 % erzielt werden.
Weitere präparative Verfahren zur Darstellung von Orthocarbonsäureestern sind beschrieben.[8]
Eigenschaften
Orthokohlensäuretetramethylester ist eine wasserklare, aromatisch riechende, niedrigviskose Flüssigkeit, die gegen Peroxidbildung stabil ist.[9]
Verwendung
Außer als Lösungsmittel findet Orthokohlensäuretetramethylester Anwendung als Brennstoff in Feststoffpolymer-Brennstoffzellen,[10] als Alkylierungsmittel bei erhöhten Temperaturen (180–200 °C),[11] als Umesterungsreagens, das aber geringere Reaktivität als Orthoameisensäuretrimethylester zeigt,[3] und als Reagens zum Aufbau von 2-Aminobenzoxazolen, die als Molekülbausteine in pharmazeutischen Wirkstoffen, z. B. Neuroleptika, Sedativa, Antiemetika, Muskelrelaxantien, Fungiziden, u. a. zu finden sind.[12]
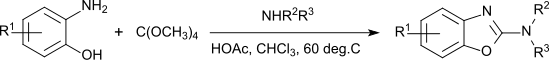
Abhängig von den Substituenten verläuft die Eintopfreaktion in „bescheidenen bis exzellenten“ Ausbeuten.
Einzelnachweise
- H. v. Hartel, Über Existenz und Darstellung des Orthokohlensäure-tetramethylesters, Ber.dtsch.chem.Ges., 60(8), 1841 (1927), doi:10.1002/cber.19270600821.
- Datenblatt Orthokohlensäuretetramethylester bei Sigma-Aldrich, abgerufen am 16. Oktober 2013 (PDF).
- R. H. De Wolfe, Carboxylic ortho acid derivatives: preparation and synthetic applications, Organic Chemistry, Vol. 14, Academic Press, Inc. New York – London, 1970, ISBN 978-0-12-214550-6.
- H. Tieckelmann, H. W. Post, The preparation of methyl, ethyl, propyl, and butyl orthocarbonates, J. Org. Chem., 13 (2), 265–267 (1948), doi:10.1021/jo01160a014.
- US-Patent US 4,059,656, Processes for neutralizing 2,3-dibromopropanol phosphoric acid esters contained in tris(2,3-dibromo-1-propyl) phosphate, Erfinder: M. Demarcq, Anmelder: Produits Chimiques Ugine Kuhlmann, erteilt am 22. November 1974.
- US-Patent US 3,876,708, Orthocarbonic acid esters, Erfinder: R. Speh, W. Kantlehner, Anmelder: Akzo B.V., erteilt am 8. April 1975.
- US-Patent US 6,825,385 B2, Process for the preparation of orthocarbonates, Erfinder: G. Fries, J. Kirchhoff, Anmelder: Degussa AG, erteilt am 30. November 2004.
- W. Kantlehner et al., Die präparative Chemie der O- und N-funktionellen Orthokohlensäure-Derivate, Synthesis; 1977(2): 73-90, doi:10.1055/s-1977-24283.
- K. R. Kopecky, J. Molina: Bis(dimethoxymethyl) peroxide and bis(1,1-dimethoxyethyl) peroxide. In: Canadian Journal of Chemistry. 65, 1987, S. 2350, doi:10.1139/v87-392.
- US-Patent US 6,864,001, Tetramethyl orthocarbonate fuel cells and systems and methods related thereto, Erfinder: J. Zhang, K. Colbow, Anmelder: Ballard Power Systems Inc., erteilt am 8. März 2005.
- M. Selva et al., Esters and Orthoesters as Alkylating Agents at High Temperature. Applications to Continuous-flow Processes, J. Chem. Soc., Perkin Trans. 2, 519 (1992), doi:10.1039/P29920000519.
- C. L. Cioffi et al., Synthesis of 2-Aminobenzoxazoles Using Tetramethyl Orthocarbonate or 1,1-Dichloro-diphenoxymethane, J. Org. Chem., 75 (2), 7942-7945 (2010), doi:10.1021/jo1017052.

