Nitrobenzoylchloride
Die Nitrobenzoylchloride bilden in der Chemie eine Stoffgruppe, die sich sowohl vom Benzoylchlorid als auch vom Nitrobenzol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter –COCl-Gruppe und Nitrogruppe (–NO2) als Substituenten. Durch deren unterschiedliche Anordnung (ortho, meta oder para) ergeben sich drei Konstitutionsisomere mit der Summenformel C7H4NO3Cl. Das 4-Nitrobenzoylchlorid findet Verwendung in der Analyse organischer Substanzen.
| Nitrobenzoylchloride | |||||||
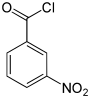
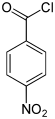
| Name | 2-Nitrobenzoylchlorid | 3-Nitrobenzoylchlorid | 4-Nitrobenzoylchlorid | ||||
| Andere Namen | o-Nitrobenzoylchlorid | m-Nitrobenzoylchlorid | p-Nitrobenzoylchlorid | ||||
| Strukturformel |  |
 |
 | ||||
| CAS-Nummer | 610-14-0 | 121-90-4 | 122-04-3 | ||||
| PubChem | 11875 | 8495 | 8502 | ||||
| Summenformel | C7H4ClNO3 | ||||||
| Molare Masse | 185,57 g·mol−1 | ||||||
| Aggregatzustand | fest/flüssig | fest | |||||
| Kurzbeschreibung | gelbe Nadeln oder orangefarbene Flüssigkeit[1] | gelber kristalliner Feststoff mit stechendem Geruch | gelbes kristallines Pulver | ||||
| Schmelzpunkt | 17–20 °C[2] | 31–35 °C[3] | 73 °C[4] | ||||
| Siedepunkt | 148–149 °C (9 hPa)[2] | (Zers.)[3] | 155 °C (20 hPa)[4] | ||||
| GHS- Kennzeichnung |
|
|
| ||||
| H- und P-Sätze | 314 | 312‐314 | 314 | ||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | |||||
| 280‐305+351+338‐310 | 280‐301+330+331 302+352‐305+351+338‐310 |
280‐301+330+331 305+351+338‐310‐402+404 | |||||
Darstellung
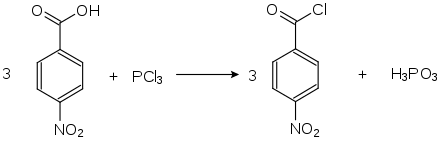
Die Nitrobenzoylchloride erhält man aus den Nitrobenzoesäuren durch Umsetzung mit Thionylchlorid (SOCl2)[5][6] oder Phosphortrichlorid (PCl3).[6]
Eigenschaften
Die Nitrobenzoylchloride sind gelbliche Flüssigkeiten bzw. kristalline Feststoffe mit stechendem Geruch. Das 4-Nitrobenzoylchlorid, das die höchste Symmetrie aufweist, besitzt den höchsten Schmelzpunkt. 2-Nitrobenzoylchlorid ist thermisch instabil. Beim Erhitzen auf Temperaturen oberhalb von 110 °C, z. B. bei Vakuumdestillationen, kann sich die Verbindung explosionsartig zersetzen.[1]
Verwendung
Das 4-Nitrobenzoylchlorid findet vor allem Verwendung in der Analyse organischer Substanzen durch Derivatisierung. Es wird den Fällen eingesetzt, wenn ein fraglicher Stoff empfindlicher ist und eine direkte Veresterung mit 4-Nitrobenzoesäure in Gegenwart von Schwefelsäure nicht möglich ist. In der Regel erfolgt die Umsetzung in Pyridin, um das freiwerdende HCl sofort zu binden.[7]
Siehe auch
Einzelnachweise
- Roth/Weller: Gefährliche Chemische Reaktionen, ecomed Sicherheit, Verlagsgruppe Hüthig Jehle Rehm, Landsberg/Lech, 31. Ergänzungslieferung 8/2000.
- Datenblatt 2-Nitrobenzoylchlorid bei Sigma-Aldrich, abgerufen am 14. Mai 2017 (PDF).
- Eintrag zu 3-Nitrobenzoylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. März 2017. (JavaScript erforderlich)
- Eintrag zu 4-Nitrobenzoylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. März 2017. (JavaScript erforderlich)
- Gattermann / Wieland: Die Praxis des organischen Chemikers, 43. Auflage, Walter de Gruyter, Berlin · New York 1982, ISBN 3-11-006654-8, S. 304: "p-Nitrobenzoylchlorid".
- Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 440.
- Autorengemeinschaft: Organikum, 19. Auflage, Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 424.