Mechanisch verzahnte Moleküle
Mechanisch verzahnte Moleküle (englisch Mechanically interlocked molecular architectures, MIMAs) sind Moleküle, die aufgrund ihrer Topologie miteinander verknüpft sind. Die Verbindungen verhalten sich wie Schlüssel an einem Schlüsselbund. Die Schlüssel sind nicht im direkten Kontakt mit der Schleife, aber sie können nicht getrennt werden, ohne die Schleife zu durchtrennen. Auf molekularer Ebene bedeutet das, dass kovalente Bindungen aufgebrochen werden müssten. Beispiele für mechanisch verzahnte Moleküle schließen Catenane, Rotaxane, molekulare Knoten (Knotane) und molekulare Borromäische Ringe ein. Arbeit auf diesem Gebiet wurde 2016 mit dem Nobelpreis in Chemie für Bernard L. Feringa, Jean-Pierre Sauvage, and J. Fraser Stoddart gewürdigt.[1][2][3][4]
Die Synthese solcher mechanisch verzahnter Architekturen wurde durch die Kombination von supramolekularer Chemie mit traditioneller Synthese möglich, jedoch haben sie Eigenschaften, die sich von supramolekularen Assemblern und von kovalenten Molekülen unterscheiden. Der Begriff der „mechanischen Bindung“ beschreibt die Verbindung zwischen den Strukturen einer mechanisch verzahnten Architektur. Obwohl die Forschung sich mit den synthetisch hergestellten mechanisch verzahnten Architekturen befasst, kann man auch Beispiele in biologischen Systemen finden: Cytokine Knoten, Cyclotide, Lasso-Peptide wie Microin J25, die zu den Proteinen gehören, und weitere Peptide.
Statt von mechanischer Bindung wird auch der Begriff topologische Bindung verwendet[5] und in diesem Zusammenhang von topologischer Isomerie und Chemischer Topologie gesprochen, ein Begriff der auf Edel Wasserman (1961) zurückgeht.
Mechanische Bindung und chemische Reaktivität
Die Einführung der mechanischen Bindung verändert die Chemie der Substrukturen der Rotaxane und Catenane. Die sterische Hinderung der reaktiven funktionellen Gruppen wächst und die Stärke der nicht-kovalenten Wechselwirkungen zwischen den Substrukturen verändert sich.[6]
Effekte der mechanischen Bindung auf nicht-kovalente Wechselwirkungen
Die Stärke der nicht-kovalenten Wechselwirkungen in einer mechanisch verzahnten Architektur wächst im Vergleich zu den unverzahnten Analoga. Die größere Stabilität wird bewiesen durch die härteren Reaktionsbedingungen, die erforderlich sind, um ein Metalltemplat-Ion von Catenanen zu entfernen, im Vergleich zu den für die unverzahnten Analoga erforderlichen Reaktionsbedingungen. Dieser Effekt wird zu den "Catenan-Effekten" gerechnet.[7][8] Das Anwachsen der Stärke der nicht-kovalenten Wechselwirkungen wird begründet mit dem Verlust eines Freiheitsgrades durch die Bildung der mechanischen Bindung. Die wachsende Stärke der nicht-kovalenten Wechselwirkungen macht sich in kleinen verzahnten Systemen, bei denen mehrere (Bewegungs-)Freiheitsgrade verloren gehen, deutlicher bemerkbar, als in großen, wo die Änderung der Freiheitsgrade geringer ist. Daher wächst die Stärke der nicht-kovalenten Wechselwirkungen bei Verkleinerung des Ringes eines Rotaxans. Ebenso beobachtet man denselben Effekt, wenn sich der Durchmesser des Molekülfadens ändert.[9]
Effekte der mechanischen Bindung auf die chemische Reaktivität
Die mechanische Bindung kann die kinetische Energie der Produkte herabsetzen. Dies wird begründet durch die größere sterische Hinderung. Wegen dieses Effekts ist die Hydrierung eines Alkans, das mit einem Rotaxan verzahnt ist, langsamer im Vergleich zu der Reaktion der unverzahnten Verbindung.[10] Dieser Effekt ermöglicht auch die Isolierung von sonst reaktiven Zwischenstufen. Die Möglichkeit, die Reaktivität zu ändern, ohne die kovalente Struktur zu ändern, führte dazu, dass MIMs für technologische Anwendungen interessant wurden.
Anwendungen der mechanischen Bindung zur Kontrolle der chemischen Reaktivität
Die Fähigkeit einer mechanischen Bindung, die Reaktivität herabzusetzen und ungewollte chemische Reaktionen zu verhindern, wurde auf einer Reihe von Gebieten erforscht. Die erste Anwendung war der Schutz eines organischen Farbstoffes vor der Zersetzung durch Umwelteinflüsse.
Beispiele
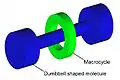


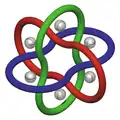 molekulare Borromäische Ringe
molekulare Borromäische Ringe
Siehe auch
- G. A. Breault, C. A. Hunter and P. C. Mayers: Supramolecular topology. In: Tetrahedron. 55, Nr. 17, 1999, S. 5265–5293. doi:10.1016/S0040-4020(99)00282-3.
Einzelnachweise
- Wesley R. Browne, Ben L. Feringa: Making molecular machines work. In: Nature Nanotechnology. 1, Nr. 1, 2006, S. 25–35. bibcode:2006NatNa...1...25B. doi:10.1038/nnano.2006.45. PMID 18654138.
- J. F. Stoddart: The chemistry of the mechanical bond. In: Chem. Soc. Rev.. 38, Nr. 6, 2009, S. 1802–1820. doi:10.1039/b819333a. PMID 19587969.
- A. Coskun, M. Banaszak, R. D. Astumian, J. F. Stoddart, B. A. Grzybowski: Great expectations: can artificial molecular machines deliver on their promise?. In: Chem. Soc. Rev.. 41, Nr. 1, 2012, S. 19–30. doi:10.1039/C1CS15262A. PMID 22116531.
- Fabien Durola, Valerie Heitz, Felipe Reviriego, Cecile Roche, Jean-Pierre Sauvage, Angelique Sour, Yann Trolez: Cyclic [4]Rotaxanes Containing Two Parallel Porphyrinic Plates: Toward Switchable Molecular Receptors and Compressors. In: Accounts of Chemical Research. 47, Nr. 2, 2014, S. 633–645. doi:10.1021/ar4002153. PMID 24428574.
- Fritz Vögtle, Supramolekulare Chemie, Teubner 1992, S. 157
- Edward A. Neal, Stephen M. Goldup: Chemical consequences of mechanical bonding in catenanes and rotaxanes: isomerism, modification, catalysis and molecular machines for synthesis. In: Chemical Communications. 50, Nr. 40, 22. April 2014, S. 5128–42. doi:10.1039/c3cc47842d. PMID 24434901.
- Anne Marie Albrecht-Gary, Zeinab Saad, Christiane O. Dietrich-Buchecker, Jean Pierre Sauvage: Interlocked macrocyclic ligands: a kinetic catenand effect in copper(I) complexes. In: Journal of the American Chemical Society. 107, Nr. 11, 1. Mai 1985, S. 3205–3209. doi:10.1021/ja00297a028.
- J.Fraser Stoddart, Carson J Bruns: The Nature of the Mechanical Bond: From Molecules to Machines. Wiley, 2016, ISBN 978-1-119-04400-0, S. 90.
- Hicham Lahlali, Kajally Jobe, Michael Watkinson, Stephen M. Goldup: Macrocycle Size Matters: "Small" Functionalized Rotaxanes in Excellent Yield Using the CuAAC Active Template Approach. In: Angewandte Chemie International Edition. 50, Nr. 18, 26. April 2011, S. 4151–4155. doi:10.1002/anie.201100415. PMID 21462287.
- Parham, Amir Hossain und Windisch, Björna und Vögtle, Fritz: Chemical Reactions in the Axle of Rotaxanes – Steric Hindrance by the Wheel, 1999-05-01 in: European Journal of Organic Chemistry, (1999), 5, 1233–1238, doi:10.1002/(SICI)1099-0690(199905)1999:53.0.CO;2-Q.