Methansulfonylchlorid
Methansulfonsäurechlorid (auch Mesylchlorid, oft abgekürzt Ms–Cl) ist das Säurechlorid der Methansulfonsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
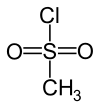 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methansulfonylchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH3ClO2S | |||||||||||||||
| Kurzbeschreibung |
gelbliche Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 114,55 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig (>20 °C) | |||||||||||||||
| Dichte |
1,48 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,4573 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Eigenschaften
Methansulfonylchlorid ist eine gelbe, nur sehr schwer entzündliche Flüssigkeit mit stechendem Geruch, welche praktisch unlöslich in Wasser ist, sich in diesem jedoch zersetzt. Sie hat eine dynamische Viskosität von 1,97 mPa·s bei 25 °C.[1]
Verwendung
Methansulfonsäurechlorid wird häufig als Reagenz bei der organischen Synthese eingesetzt. In der Regel lassen sich bei nucleophilen Substitutionen Hydroxygruppen von Alkoholen nicht direkt ersetzen. Deshalb wird der Alkohol zunächst mit Methansulfonylchlorid zum Methansulfonsäureester (Mesylat) umgesetzt. Das Mesylat ist eine sehr gute Abgangsgruppe und kann in der Regel durch ein Nucleophil substituiert werden.
Einzelnachweise
- Eintrag zu Methansulfonylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1029, ISBN 978-0-911910-00-1.
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 9. Auflage, Merck & Co., 1976, S. 776, ISBN 0-911910-26-3.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-326.

