McLafferty-Umlagerung
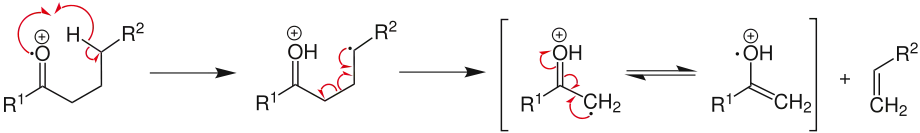
Die McLafferty-Umlagerung ist eine chemische Reaktion, die nur unter den Bedingungen der Massenspektrometrie ablaufen kann. Es handelt sich dabei um eine Reaktion, die vergleichbar ist mit der Ester-Pyrolyse oder der En-Reaktion. Die Reaktion ist nach ihrem Entdecker Fred McLafferty benannt. Ein doppelbindungshaltiges Substrat, das zu Beginn der Reaktion als Radikalkation vorliegt, spaltet ein neutrales Molekül ab (im Beispiel unten ein Alken), wobei das verbleibende Fragment wieder als Radikalkation vorliegt. Bei einem Aldehyd (R1 = H, R2 = H oder Organylgruppe, wie z. B. Alkyl) bzw. einem Keton (R1 = Organylgruppe, R2 = H oder Organylgruppe) läuft die Reaktion so ab:

Geeignete Substrate
Typische Substrate für die Umlagerung sind Verbindungen mit mindestens einer Doppelbindung. Die Doppelbindung kann zwischen zwei Kohlenstoffatomen in Alkenen (C=C), zwischen einem Kohlenstoffatom und einem Heteroatom (C=N, C=O) oder auch zwischen zwei Heteroatomen (S=O) liegen.
Für C=O-Bindungen sind Aldehyde, Ketone, Ester, Carbonsäuren, Lactone, Lactame und Amide geeignete Edukte, geeignete C=N-haltige Verbindungen sind u. a. Hydrazone, Schiffsche Basen und Semicarbazone, für S=O kommen nur Sulfonsäuren als potenzielle Ausgangsverbindungen infrage. In der Regel verläuft die McLafferty-Umlagerung eingebettet in eine lange Kaskade von Zerfallsreaktionen, d. h., die Substrate können von Beginn an vorhanden sein oder erst durch andere Zerfallsreaktionen entstehen.
Mechanismus
Zunächst läuft über einen sechsgliedrigen Übergangszustand die Übertragung des Wasserstoffatoms aus der γ-Position auf das radikalische Heteroatom ab. Das dann dreifach gebundene (Hetero-)Atom trägt nun eine positive Ladung, während das Kohlenstoffatom an der γ-Position nun als Radikal vorliegt. Da primäre bzw. sekundäre Radikale thermodynamisch und kinetisch instabil sind, erfolgt eine Bindungsverschiebung und das neutrale Abgangsmolekül (hier: ein Alken) wird abgespalten. Das Radikal liegt nun direkt neben einer Doppelbindung, die besser in der Lage ist, es durch mesomere Effekte zu stabilisieren. Diese bessere Stabilisierung ist die Triebfeder für die Abspaltung des kleinen Moleküls.
Literatur
- Manfred Hesse, Herbert Meier, Bernd Zeeh: Spektroskopische Methoden in der organischen Chemie. 5., überarb. u. erw. Auflage. Thieme Georg Verlag, Stuttgart 1995, ISBN 3-13-576105-3.
- Zerong Wang: Comprehensive Organic:Name Reactions and Reagents. Wiley Verlag, 2009, ISBN 978-0-471-70450-8, S. 1856–1859.