MOF-5
MOF-5 (auch IRMOF-1) ist neben HKUST-1 und MIL-53 die bekannteste und am besten untersuchte MOF-Struktur. Sie wurde erstmals 1999 von der Arbeitsgruppe von Omar M. Yaghi (University of Michigan) hergestellt.[4]
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
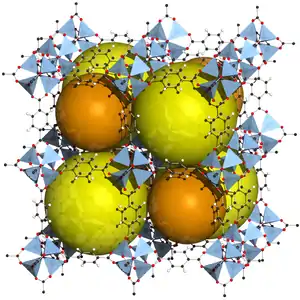 | |||||||
| Acht Zellen von MOF-5, Kugeln zur Verdeutlichung der in der Struktur vorhandenen Poren | |||||||
| Allgemeines | |||||||
| Name | MOF-5 | ||||||
| Andere Namen |
| ||||||
| Verhältnisformel | C24H12O13Zn4 | ||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 769,99 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Schmelzpunkt |
350-350 °C (Zersetzung)[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Struktur
MOF-5 kristallisiert in der kubischen Raumgruppe Fm3m (Raumgruppen-Nr. 225). Die Struktur lässt sich von einem Würfel ableiten, auf dessen acht Ecken die Zn4O-Knotenpunkten (SBU) lokalisiert sind und durch Terephthalat-Linker linear verbunden werden. Das Zentrum der SBUs bildet ein O2−-Ion, das tetraedrisch von vier Zn2+-Ionen umgeben ist. Diese werden wiederum von den Carboxylatgruppen der Terephthalat-Linker verbrückt, so dass ein oktaedrischer Knotenpunkt mit sechs umgebenden Terephthalaten entsteht, die entlang der Würfelkanten angeordnet sind. Aus energetischen Gründen befinden sich die Carboxygruppen der Terephthalatliganden in einer Ebene mit dem aromatischen Ring. Dadurch ordnen sich die Knotenpunkte im Wechsel spiegelbildlich an, womit die Ausbildung zweier verschieden großer Poren verbunden ist, da sich die aromatischen Ringen der Terephthalat-Liganden entweder in die Pore orientiert sind oder aus ihr heraus. Die große Pore hat eine Öffnung von 13,8 Å, die kleine Pore von 9,2 Å.
Synthese
Diffusionsmethode
Die erste Darstellung von MOF-5 erfolgte durch die langsame Diffusion von Triethylamin in eine Lösung von Zinknitrat Hexahydrat und Terephthalsäure in N,N-Dimethylformamid mit Chlorbenzol als Templat.[4]
Solvothermale Synthese
Solvothermale Synthesen, bei denen die Reaktion bei erhöhter Temperatur in einem geschlossenen Gefäß durchgeführt wird, wurden auch für MOF-5-Materialien entwickelt. Dabei werden ausgehend von Zinknitrat Hexahydrat und Terephthalsäure in N,N-Diethylformamid bei Temperaturen von 85–105 °C große Kristalle der Verbindung erhalten, in deren Poren sich N,N-Diethylformamid als Gastmoleküle befindet.[5] Genaue Untersuchungen der Reaktion haben gezeigt, dass die Bildung des Zn4O-SBUs auf die Zersetzung des NO3−-Anions im Lösungsmittel zurückzuführen ist. Weiterhin ist ein sehr geringer Wassergehalt für die Bildung von MOF-5 wichtig, da sich sonst MOF-69c oder Zinkterephthalate bilden.[6]
Nachträglicher Oxideinbau
Für die Darstellung von MOF-5 mit hoher Porosität ist die solvothermale Synthese die am weitesten verbreitete. Nachteilig ist jedoch der hohe Verbrauch an N,N-Diethylformamid als Lösungsmittel. Dieser kann jedoch durch die Methode des nachträglichen Oxideinbaus drastisch gesenkt werden. Das Verfahren beinhaltet zwei Stufen:
1. Ausfällen des gewöhnlichen Zinksalzes des Linker (hier Terephthalsäure, H2BDC) in Wasser:
ZnCl2 + Na2BDC + 2 H2O → ZnBDC·2H2O↓ + 2 NaCl
2. Umsetzen des Salzes mit einer Oxidquelle unter Erwärmen in Suspension mit N,N′-Diethylformamid:
3 ZnBDC·2H2O + Zn(NO3)2·4H2O → MOF-5↓ + 2 NO2 + 0,5 O2 + 10 H2O
Der Vorteil besteht vor allem darin, dass statt mit verdünnten Lösungen in hochkonzentrierten Suspensionen arbeiten kann, was zu einer Steigerung der Raumzeitausbeute auf ca. 900 % gegenüber dem solvothermalen Verfahren führt.[7]
Inverse Synthese
Bei der inversen Synthese (auch "Controlled SBU Approach") wird zunächst eine Komplexverbindung hergestellt, die den Knotenpunkt Zn4O enthält, wie er auch in MOF-5 enthalten ist. Geeignet sind z. B. die schon seit langem bekannten Komplexe Zinkoxoacetat [Zn4O(OOCCH3)6] oder Zinkoxobenzoat [Zn4O(OOCC6H5)6], die ihrer Carboxylatliganden in Lösung gegen andere Carboxylate austauschen. Auf diesem Weg des Ligandenaustauschs können in Lösung die Acetat- oder Benzoat-liganden durch Terephthalat ausgetauscht werden, wobei sich MOF-5 und Essigsäure bzw. Benzoesäure bilden. Dabei ist auch die Wahl des Lösungsmittels entscheidend, da sonst durch die Terephthalsäure die Protonierung des Oxozentrums von Zinkoxoacetat oder Zinkoxobenzoat erfolgt und der Knotenpunkt zerstört wird.[8]
Basenfällungsmethode
Zur Synthese mikrokristalliner MOF-5 Partikel ist die Fällung aus einer Lösung von Zinkacetat Dihydrat in N,N-Dimethylformamid mit Triethylamin und Terephthalsäure eine bequeme Methode. Das dabei erhaltene Material besitzt jedoch eine geringere Porosität als MOF-5, der auf solvothermalen Weg hergestellt wurde.[9]
Stabilität
MOF-5 ist an trockener Luft beständig, zersetzt sich jedoch an feuchter Luft durch den Kontakt mit Wasser. Besonders empfindlich ist die Struktur gegen Luftfeuchtigkeit in Gegenwart von N,N-Diethylformamid, da eine Umwandlung in MOF-69c erfolgt.[6] Die Umwandlung und Zersetzung beruht auf der Protonierung des Zn4O-Oxozentrums. Das durch die Synthese in den Poren eingeschlossene Lösungsmittel kann thermisch ohne eine Zerstörung des Netzwerks entfernt werden. Die thermische Zersetzung von MOF-5 erfolgt ab ca. 320 °C, wobei zuletzt ZnO entsteht.
Anwendung
MOF-5 ist in der Diskussion als Material für die Gasspeicherung, besonders für Wasserstoff und Methan. Die Wasserstoff-Speicherkapazität beträgt 7,1 Gew.% bei 77 K und 40 bar; 10 Gew.% bei 100 bar; entsprechend 66 g·l−1.[10]
Analoga
Mittlerweile wurden durch inverse Synthese Beryllium- und Cobalt-Analoga von MOF-5 synthetisiert[11] Außerdem wurden verschiedene Linker mit zusätzlichen funktionellen Gruppen oder einer anderen Länge eingesetzt, um strukturelle Analoga mit anderen Porengrößen oder Eigenschaften der Poren zu erreichen.[12][5] Diese Materialien wurden IRMOF-n genannt, wobei n = 2, 3, 4 … ist (IRMOF-1 = MOF-5).
Literatur
- Dipendu Saha, Shuguang Deng, Zhiguan Yang: Hydrogen adsorption on metal-organic framework (MOF-5) synthesized by DMF approach. In: Journal of Porous Materials, 2009, 16(2), S. 141–149, doi:10.1007/s10934-007-9178-3.
Einzelnachweise
- Organic Frame Material / Alfa Chemistry: CAS 255367-66-9 MOF 5 - Organic Frame Material / Alfa Chemistry, accessdate: 17. Januar 2022
- Sheng Wang, Xianfei Xie, Wenke Xia, Jiaming Cui, Shengquan Zhang, Xueyan Du: Study on the structure activity relationship of the crystal MOF-5 synthesis, thermal stability and N2 adsorption property. In: High Temperature Materials and Processes. Band 39, Nr. 1, 2020, ISSN 2191-0324, S. 171–177, doi:10.1515/htmp-2020-0034 (degruyter.com).
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Hailian Li, Mohamed Eddaoudi, Michael O'Keeffe, Omar M. Yaghi: Design and synthesis of an exceptionally stable and highly porous metal-organic framework. In: Nature. Band 402, 1999, S. 276–279, doi:10.1038/46248.
- Mohamed Eddaoudi, Jaheon Kim, Nathaniel Rosi, David Vodak, Joseph Wachter, Michael O'Keeffe, Omar M. Yaghi: Systematic Design of Pore Size and Functionality in Isoreticular MOFs and Their Application in Methane Storage. In: Science. Band 295, Nr. 5554, 18. Januar 2002, S. 469–472, doi:10.1126/science.1067208.
- S. Hausdorf, J. Wagler, R. Moßig, F. O. R. L. Mertens, J. Phys. Chem. A, 2008, 112 (33), 7567–7576, doi:10.1021/jp7110633.
- S. Hausdorf, F. Mertens, F. Baitalow, J. Seidel, DE 10 2008 026 713 A1 "Verfahren zur Herstellung von oxidbasierten metallorganischen Gerüstmaterialien mittels Reaktion unter Oxideinbau".
- S. Hausdorf, F. Mertens, F. Baitalow, J. Seidel, R. Fischer DE 10 2008 026 714 A1 "Verfahren zur Herstellung von oxidbasierter Metall-organischer Gerüstmaterialien mittels inverser Synthese".
- D. J. Tranchemontagne, J. R. Hunt, O. M. Yaghi, Tetrahedron, 2008, 64, 8553–8557.
- Steven S. Kaye et al.: Impact of Preparation and Handling on the Hydrogen Storage Properties of Zn4O(1,4-benzenedicarboxylate)3 (MOF-5). J. Am. Chem. Soc. 129, 2007, doi:10.1021/ja076877g (freier Volltext).
- Steffen Hausdorf, Felix Baitalow, Tony Böhle, David Rafaja, Florian O. R. L. Mertens: Main-Group and Transition-Element IRMOF Homologues. In: Journal of the American Chemical Society. Band 132, Nr. 32, 18. August 2010, S. 10978–10981, doi:10.1021/ja1028777.
- Zehan Mai, Dingxin Liu: Synthesis and Applications of Isoreticular Metal–Organic Frameworks IRMOFs- n ( n = 1, 3, 6, 8). In: Crystal Growth & Design. Band 19, Nr. 12, 4. Dezember 2019, ISSN 1528-7483, S. 7439–7462, doi:10.1021/acs.cgd.9b00879.