Loratadin
Loratadin ist ein Arzneistoff aus der Gruppe der Antihistaminika, der zur Linderung der Beschwerden bei Allergien und beim atopischen Ekzem (Neurodermitis) eingesetzt wird. Es wurde 1989 in Deutschland eingeführt und ist seit 1994 nicht mehr verschreibungspflichtig. In Österreich ist es in Dosierungen bis 10 mg pro Tag für Jugendliche über 12 Jahren und Erwachsene ohne Rezept erhältlich.[4] In Deutschland sind Fertigarzneimittel mit Loratadin als Tablette oder Brausetablette erhältlich, in den USA und Großbritannien gibt es zusätzlich Saft. Seit 2013 steht es auf der Liste der unentbehrlichen Arzneimittel der WHO.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
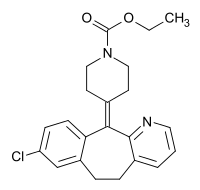 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Loratadin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C22H23ClN2O2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis fast weißes, polymorphes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
R06AX13 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 382,88 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkmechanismus
Loratadin ist ein H1-Antihistaminikum der 2. Generation. Es blockiert die speziellen Bindungsstellen für Histamin an den Histamin-H1-Rezeptoren. Histamin findet somit nicht mehr genügend freie Bindungsstellen, um seine Wirkungen (z. B. Hautrötung, Juckreiz, Blutdruckabfall und Bronchospasmen) auszuüben. Als Vertreter der 2. Generation der H1-Antihistaminika ist Loratadin weitgehend frei von Nebenwirkungen auf das Zentralnervensystem, wie z. B. Sedierung. Ursache ist der Rücktransport der Substanz durch permeable Glykoproteine an der Blut-Hirn-Schranke.[5] Durch die Veresterung der Säuregruppe wird zudem eine gute Resorption ermöglicht. Loratadin wird im Organismus rasch zu Desloratadin abgebaut, das jedoch eine drei- bis vierfach höhere Affinität zum H1-Rezeptor besitzt. Daher kann Loratadin formal als Prodrug des Desloratadins angesehen werden. Beide Substanzen wirken zudem als FIASMA (funktioneller Hemmer der sauren Sphingomyelinase).[6] Die Plasmahalbwertszeit liegt bei ca. acht Stunden, die der Metaboliten bei 12 bis 24 Stunden.
Nebenwirkungen
Neben unspezifischen Nebenwirkungen wie Kopfschmerz, Müdigkeit und Störungen des Magen-Darm-Traktes treten gelegentlich Mundtrockenheit und in Einzelfällen Haarausfall, Leberfunktionsstörungen und allergische Reaktionen auf. Vereinzelt werden auch Herzrhythmusstörungen beobachtet. In seltenen Fällen kann es auch zu Tinnitus kommen.[7]
Wechselwirkungen
Loratadin wird über das Enzym CYP3A4 abgebaut.[8] Bei gleichzeitiger Einnahme von Mitteln, die das Enzym CYP3A4 hemmen oder ähnliche Nebenwirkungen haben, zum Beispiel Ketoconazol, Erythromycin, Makrolid-Antibiotika, HIV-Proteaseinhibitoren, Propafenon und Grapefruitsaft, können die genannten Nebenwirkungen verstärkt werden, insbesondere Herzrhythmusstörungen.[9][10]
Patentstreit
Nach dem Auslaufen der Patentfrist für die Herstellung von Loratadin entstand ein größerer Rechtsstreit: Schering-Plough verklagte Geneva Pharmaceuticals für die Herstellung von Loratadin-Generika basierend auf der Argumentation, dass Schering-Plough ein noch gültiges Patent auf die künstliche Herstellung des Loratadin-Metaboliten Descarboethoxyloratadin (Desloratadin) habe. Da die Einnahme von Loratadin beim Menschen auch zur Bildung von Descarboethoxyloratadin führe, verletze die Herstellung von Loratadin dieses Patent. Das US-Bundesberufungsgericht entschied zugunsten von Geneva, was zu starken Bedenken bei Pharmaunternehmen über die Schutzmöglichkeiten ihrer Produkte führte.[11] Tatsächlich sei der therapeutische Vorteil von Desloratadin gegenüber Loratadin aber entsprechend marginal[12], so dass bei großer zeitlicher Nähe zwischen dem Wegfall des Patentschutzes für Loratadin und der Markteinführung von Desloratadin[13] Kritik an einem Evergreening des Medikamentes geübt wurde.
Handelsnamen
Allernon (A), Claritine (CH), Clarityn (A), Toppoll (A), Lorano (D), Lora-ADGC (D), und diverse Generika (D, A, CH)
- Kombinationspräparate
- mit Pseudoephedrin: Clarinase (A)
Einzelnachweise
- Europäische Arzneibuch-Kommission (Hrsg.): EUROPÄISCHE PHARMAKOPÖE 6. AUSGABE. Band 6.0–6.2, 2008.
- Eintrag zu Loratadine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Datenblatt Loratadine bei Sigma-Aldrich, abgerufen am 29. Mai 2011 (PDF).
- Gesamte Rechtsvorschrift für Rezeptpflichtverordnung. Rechtsinformationssystem des Bundes. 23. Oktober 2014. Abgerufen am 23. Oktober 2014.
- https://www.ncbi.nlm.nih.gov/pubmed/?term=P-GLYCOPROTEIN+LIMITS+THE+BRAIN+PENETRATION+OF+NONSEDATING+BUT+NOT+SEDATING+H1-ANTAGONISTS
- Kornhuber J, Muehlbacher M, Trapp S, Pechmann S, Friedl A, Reichel M, Mühle C, Terfloth L, Groemer T, Spitzer G, Liedl K, Gulbins E, Tripal P: Identification of novel functional inhibitors of acid sphingomyelinase. In: PLoS ONE. 6, Nr. 8, 2011, S. e23852. doi:10.1371/journal.pone.0023852.
- ehealthme.com: Could Loratadine cause Tinnitus?
- Annette Immel-Sehr: Wenn die Abwehr Amok läuft. In: Pharmazeutische Zeitung. Nr. 16, 2007 (online).
- Cornelia Rufke, Universität Leipzig: [https://de.wikipedia.org/w/index.php?title=Wikipedia:Defekte_Weblinks&dwl=http://www.uni-leipzig.de/~pharm/phfn/allrufke.pdf Seite nicht mehr abrufbar], Suche in Webarchiven: [http://timetravel.mementoweb.org/list/2010/http://www.uni-leipzig.de/~pharm/phfn/allrufke.pdf Fallbeispiel Interaktion Azol-Antimykotika – Terfenadin] (PDF; 243 kB)
- QT-Verlängerungen nach Einnahme des Antihistaminikums Loratadin. BfArM, 1. August 2002, abgerufen am 12. September 2017.
- A. De La Rosa: A Hard Pill to Swallow – Does Schering v. Geneva Endanger Research and Development within the Pharmaceutical Industry? 6. Juni 2006, bepress Legal Series. Working Paper 1414.
- Ulrich Schwabe, Dieter Paffrath: Arzneiverordnungs-Report 2004: Aktuelle Daten, Kosten, Trends und Kommentare. Springer, 2004, ISBN 3-540-21359-7.
- Antje-Christina Raasch: Strategie und Erfolgsfaktoren beim Patentauslauf des Antihistaminikums Lisino von essex pharma. In: Der Patentauslauf von Pharmazeutika als Herausforderung beim Management des Produktlebenszyklus. Springer, 2006, ISBN 978-3-8350-0632-4, S. 211–225.