Kardiale Kontraktilitätsmodulation
Die kardiale Kontraktilitätsmodulation oder CCM™ ist eine von Impulse Dynamics NV entwickelte Therapie. Patienten mit mittelschwerer bis schwerer Herzinsuffizienz (NYHA-Klasse II-IV) und Symptomen trotz optimaler medikamentöser Therapie können von einer Besserung der Auswurfleistung des Herzens profitieren. Die kurz- und langfristige Anwendung dieser Therapie verbessert die Stärke der ventrikulären Kontraktion und damit die Pumpleistung des Herzens durch Modulation (Anpassung) der myokardialen Kontraktilität. Eine Verringerung der Gesamt-Mortalität konnte mittels randomisiert-kontrollierter Studien bislang jedoch nicht nachgewiesen werden.[1]
Die kardiale Kontraktilitätsmodulation wird mit Hilfe eines implantierten herzschrittmacherähnlichen Geräts durchgeführt, das nicht-exzitatorische Stimulationen (NES) zeitlich auf den elektrischen Herzzyklus abgestimmt an den Herzmuskel abgibt. Anders als ein Schrittmacher, der ein elektrisches Signal mit der Absicht liefert, zu einer Herzkontraktion zu führen, wendet diese Therapie NES an, welche angepasst und synchronisiert an die elektrische Aktion im Herzzyklus abgegeben werden.[2][3][4]
Die Abgabe der elektrischen Signale an den Herzmuskel erfolgt bei der kardialen Kontraktilitätsmodulation während der absoluten Refraktärzeit der Herzmuskelzellen. In dieser Phase des Herzzyklus können elektrische Signale keine Bewegungen des Herzmuskels auslösen (nicht-exzitatorische Stimulation). Die verwendeten Signale erhöhen jedoch den Einstrom von Kalzium in die Herzmuskelzellen (Kardiomyozyten).[5][6] Im Gegensatz zu anderen funktionell-elektrostimulativen Verfahren zur Behandlung der Herzinsuffizienz wie bei der Therapie mit Herzschrittmachern oder implantierbaren Kardioverter-Defibrillatoren (ICD) wirkt sich die kardiale Kontraktilitätsmodulation also nicht unmittelbar auf den Herzrhythmus aus, sondern zielt auf eine mittel- bis langfristige Verbesserung der Herzleistung ab. Eine zusammenfassende Auswertung (Metastudie) der vorliegenden Studien aus dem Jahr 2014[3] sowie eine Überblicksdarstellung der apparativen Behandlungsoptionen bei Herzinsuffizienz aus dem Jahr 2013[2] kamen zu dem Schluss, dass die Behandlung der kardialen Kontraktilitätsmodulation sicher ist,[2][3] Herzinsuffizienz-Patienten generell davon profitieren[2][7] und die Therapie die Belastbarkeit (Exercise tolerance, ET) und die Lebensqualität von Patienten mit bestimmten Formen der Herzinsuffizienz verbessern kann.[3] Darüber hinaus zeigen vorläufige Daten zum Langzeitüberleben, dass Patienten, die die Therapie erhielten, im Vergleich zur erwarteten Sterblichkeit (Mortalität) in einer vergleichbaren Patientengruppe ohne die kardiale Kontraktilitätsmodulation eine verminderte Herzinsuffizienz-Sterblichkeit aufwiesen.[8]
Zulassung und Indikation
Zulassung
Auf Grundlage klinischer Untersuchungen sind die Geräte derzeit in allen Ländern der EU, in Australien, der Türkei, Indien, Hongkong sowie in allen weiteren Ländern zugelassen und verfügbar, die die CE-Kennzeichnung für medizinische Geräte verwenden.[4][9][10]
In den USA wurde die kardiale Kontraktilitätsmodulation am 21. März 2019 von der U.S. Food and Drug Administration (FDA) zur klinischen Verwendung zugelassen.
Indikation

Gemäß der Zulassung stellt die kardiale Kontraktionsmodulation eine Behandlungsoption für Patienten ab 18 Jahren dar, die trotz medikamentöser Therapie aufgrund einer linksventrikulären systolischen Dysfunktion (LVSD) an Beschwerden einer Herzinsuffizienz leiden. Welche Patientengruppen innerhalb der Rahmenvorgaben der Gerätezulassung in besonderem Maß von der kardialen Kontraktilitätsmodulation profitieren, ist Gegenstand weiterer Forschung.[2][3][4][10]
Kriterien für die Einteilung von Patienten mit linksventrikulärer systolischer Herzinsuffizienz sind u. a. die Schwere der Erkrankung nach funktionellen Gesichtspunkten (NYHA-Klasse), der durchschnittliche Anteil der Blutmenge in der linken Herzkammer, der bei einem Herzschlag ausgeworfen wird (linksventrikuläre Ejektionsfraktion, LVEF) und die Dauer des QRS-Komplexes in der Elektrokardiogramm-Kurve (EKG-Kurve). Studien zur kardialen Kontraktilitätsmodulation wurden überwiegend mit Patienten durchgeführt, die an einer Herzinsuffizienz der NYHA-Klassen II, III oder IV litten und eine normale Dauer des QRS-Komplexes (QRS-Dauer ≤ 120 ms) aufwiesen. Die Wirksamkeit der kardialen Kontraktilitätsmodulation bei Patienten in frühen Stadien der Herzinsuffizienz wurde bisher nicht untersucht.[3][11]
Gemäß der nachträglichen Auswertung (Subgruppenanalyse) einer Studie könnte eine Gruppe von Patienten bestehen, die überdurchschnittlich gut auf die Therapie ansprach. Diese Patienten waren durch eine Erkrankungsschwere der NYHA-Klasse III und eine Auswurffraktion der linken Herzkammer (linksventrikuläre Ejektionsfraktion) ≥ 25 % charakterisiert.[2][12]
Obwohl sich Studien zur kardialen Kontraktilitätsmodulation bisher auf Patienten mit einer (normalen) QRS-Dauer ≤ 120 ms konzentrierten, kann die Therapie unabhängig von der QRS-Dauer bei allen Patienten eingesetzt werden, die die Indikationkriterien der kardialen Kontraktilitätsmodulation erfüllen.[13][4][14] Eine vorläufige Untersuchung hatte bereits früher gezeigt, dass die Behandlung auch bei Patienten wirksam und sicher ist, die zuvor nicht auf eine kardiale Resynchronisationstherapie (CRT) angesprochen hatten.[15]
Therapeutische Lücke der Herzinsuffizienz-Behandlung
Die kardiale Resynchronisationstherapie (engl. Cardiac Resynchronization Therapy, CRT, auch bekannt als biventrikuläre Schrittmacherbehandlung) hat sich bei Herzinsuffizienz bewährt.[16] Sie wird – verkürzend zusammengefasst – jedoch ausschließlich für Patienten mit erhaltenem Sinusrhythmus empfohlen, die einen QRS-Komplex mit einer Breite ≥ 120 ms und zusätzlich einen Linksschenkelblock bzw. ohne Linksschenkelblock einen QRS-Komplex mit einer Breite ≥ 150 ms aufweisen.[16] Ein solcher verlängerter QRS-Komplex liegt jedoch nur bei etwa 30–40 % der Herzinsuffizienz-Patienten vor. 60–70 % der Patienten weisen hingegen einen normalen QRS-Komplex auf und können deshalb nicht mit kardialer Resynchronisationstherapie behandelt werden. Darüber hinaus sprechen etwa 30 % der für die CRT-Behandlung in Frage kommenden Patienten nicht auf die Therapie an.[3][11][4]
Eine apparative Alternativ- oder Ergänzungsbehandlung zur medikamentösen Therapie existierte bisher nur in Form der Implantation eines Kunstherzens (Herzunterstützungssystem). Diese ist nur bei schwerkranken Patienten angezeigt und ist mit einer mehrstündigen Operation unter Einsatz einer Herz-Lungen-Maschine verbunden. Bei Herzinsuffizienz-Patienten werden Kunstherzen in der Regel nur zur Überbrückung der Wartezeit bis zu einer Herztransplantation eingesetzt.[3][11][13]
Aktuelle Forschungsergebnisse deuten an, dass die beschriebene therapeutische Lücke bei der Herzinsuffizienz-Behandlung von der kardialen Kontraktilitätsmodulation geschlossen werden könnte.[3][11][13] Darüber hinaus war die kardiale Kontraktilitätsmodulation in einer Langzeit-Studie in der Lage, die bei Herzinsuffizienz oft auftretende und prognostisch ungünstige Zunahme der QRS-Dauer bei Herzinsuffizienz-Patienten mit anfangs normaler QRS-Dauer aufzuhalten. Dieses Ergebnis wurde als Bestätigung der Sicherheit der Behandlung und Hinweis gewertet, dass Patienten langfristig von der Behandlung profitieren könnten. Sollte sich der QRS-stabilisierende Effekt der Therapie in weiteren Studien bestätigen, wäre die kardiale Kontraktilitätsmodulation die erste apparative Behandlung der Herzinsuffizienz, die die bei Herzinsuffizienz prognostisch ungünstige Zunahme der QRS-Dauer aufhalten könnte.[17]
Leitlinienempfehlungen
In den Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) von 2016 wird die kardiale Kontraktilitätsmodulation als eine Therapieoption genannt, die bei ausgewählten Patienten mit Herzinsuffizienz zu berücksichtigen ist.[18]
Kontraindikation
Die wichtigste Kontraindikation (Gegenanzeige) für die Behandlung der kardialen Kontraktilitätsmodulation ist permanentes oder wiederholtes länger anhaltendes Vorhofflimmern oder -flattern. Die Signalabgabe der verfügbaren Systeme wird auf Grundlage des elektrischen Signals der Herzvorhöfe (atriales Signal) berechnet und ausgelöst. Bei Vorhofflimmern oder -flattern ist das atriale elektrische Signal jedoch stark gestört und daher keine zuverlässige Grundlage der Signalberechnung. Das gilt in gleicher Weise auch für andere Störungen, die zu einer erheblichen Störung oder dem Ausbleiben des elektrischen Vorhofsignals führen.[19] In der wissenschaftlichen Literatur wurde daher bereits ein verbesserter Algorithmus als wünschenswert bezeichnet, der unabhängig von den elektrischen Signalen der Herzvorhöfe arbeiten würde. Eine erste Studie konnte zudem nachweisen, dass ein veränderter Algorithmus die Behandlung von Patienten mit permanentem Vorhofflimmern ermöglichen kann.[19]
Größere Abweichungen vom Sinusrhythmus wie sie bei häufigen zusätzlichen Herzschlägen (höhergradige Extrasystolie) oder einer ausgeprägten Signalweiterleitungsstörung im Herzen (AV-Blockierung von mehr als 300 ms) vorkommen, stellen ebenfalls Kontraindikationen dar. Bei bestehendem Linksschenkelblock und einer Breite des QRS-Komplexes ≥ 120 ms bzw. ohne Linksschenkelblock bei einer Breite des QRS-Komplexes ≥ 150 ms sollte eine CRT mittels biventrikulärem Herzschrittmacher in Betracht gezogen werden.[7][16]
Die kardiale Kontraktilitätsmodulation kann gleichfalls nicht eingesetzt werden, wenn die technisch erforderlichen Elektroden nicht wie vorgesehen im Herzen positioniert werden können. Das kann z. B. bei einer künstlichen Herzklappe zwischen rechtem Vorhof und rechter Herzkammer (künstliche Trikuspidalklappe) der Fall sein, deren Funktion durch eine Herzkammerelektrode behindert würde, oder wenn es – etwa in Folge einer Thrombose – nicht gelingt, die Elektroden über die großen Venen der oberen Körperhälfte bis zum Herz vorzuschieben (diese Einschränkungen gelten gleichermaßen u. a. auch für die Herzschrittmacher- und ICD-Behandlung). Eine Kontraindikation besteht darüber hinaus bei Patienten mit VVI-Herzschrittmacher, die zu 100 % stimuliert werden.[7][14]
Wirkmechanismus
Der Wirkmechanismus der kardialen Kontraktilitätsmodulation ist seit Entdeckung der Behandlungsmethode Gegenstand fortlaufender Forschung. Anhand von Tierversuchen und Untersuchungen von menschlichem Herzmuskelgewebe, das durch Biopsien gewonnen wurde, konnten bis heute wesentliche Teilschritte des Wirkmechanismus entschlüsselt werden.[14][20]
Nach aktuellem Verständnis (Stand: Februar 2015) kann der Wirkmechanismus der kardialen Kontraktilitätsmodulation wie folgt zusammengefasst werden: Die elektrischen, während der elektrischen Nicht-Erregbarkeit der Herzmuskelzellen (absolute Refraktärzeit) verabreichten Signale bewirken einen vermehrter Einstrom von Kalzium in die Zellen. Dadurch verlängert sich die elektrische Erregung der Zellen. Die Muskelfunktion wird gestärkt. Innerhalb von Minuten kommt es darüber hinaus zu einer Umstellung und schließlich zu einer Normalisierung des bei Herzinsuffizienz gestörten Zellstoffwechsels durch eine veränderte Aktivierung der Erbinformation der Zelle.[20] Diese günstige Wirkung tritt anfangs nur in der Nähe der Elektroden auf, breitet sich aber mit zunehmender Anwendungsdauer auch in elektrodenferne Bereiche der Herzmuskulatur aus. Es kommt zu einem Rückumbau der geschädigten Zellen hin zu einer gesünderen Struktur und Funktion. In günstigen Fällen können krankheitsbedingte Veränderungen an den Herzkammern teilweise rückgängig gemacht werden. Dieser Prozess wird als reverses Remodeling oder Re-Remodeling bezeichnet.[4][5][6][14][21]
Funktionsweise der Geräte
Aufbau
Die Geräte der kardialen Kontraktilitätsmodulation ähneln in ihrem Aufbau anderen implantierbaren Geräten zur Unterstützung der elektrischen Herzstimulation wie Herzschrittmachern oder implantierbaren Kardioverter-Defibrillatoren (ICD).[14] Die Geräte bestehen (Stand: Februar 2015) aus vier Komponenten:[14]

- Implantierbarer Pulsgenerator: Der Impulsgenerator (engl. Implantable Pulse Generator, IPG) erzeugt die Signale. Der gegenwärtig verwendete IPG ist in der Fläche etwas größer, dafür aber etwas flacher als eine Streichholzschachtel(ca. 6,5 cm × 4,8 cm × 1,2 cm). Der Impulsgenerator wird dem Patienten in der Regel unterhalb des rechten Schlüsselbeins unter der Haut oder unter der Brustmuskulatur eingepflanzt (implantiert). Dabei kann durch den IPG eine fühl- und teilweise auch sichtbare Vorwölbung entstehen. 2015 standen noch keine Geräte zur Verfügung, die auch die Funktionalität anderer, mit der kardialen Kontraktilitätsmodulation kombinierbarer elektrostimulativer Geräte wie Herzschrittmacher oder implantierbarer Kardioverter-Defibrillatoren übernehmen könnten. Die Entwicklung solcher Kombigeräte wurde in der Fachliteratur aber bereits angeregt.[11]
- Elektroden: Aktuelle Geräte der kardialen Kontraktilitätsmodulation (Stand: Oktober 2014) verfügen über drei Standard-Herzschrittmacherelektroden. Dabei handelt es sich um spezielle medizinische Kabel, die die elektrischen Signale vom Impulsgenerator zum Herzen leiten. Die Elektroden werden unterhalb des Schlüsselbeins in die Schlüsselbeinvene (Vena subclavia) oder seltener in die Achselvene (Vena axillaris) oder die Vena cephalica eingeführt und über die obere Hohlvene (Vena cava superior) bis zum rechten Vorhof bzw. bis in die rechte Herzkammer (rechter Ventrikel) vorgeschoben. Die Elektrode im rechten Vorhof erfasst die elektrischen Signale der Vorhöfe und leitet sie zum Impulsgenerator. Dieser errechnet die erforderlichen Signale und gibt sie über die beiden Elektroden in der rechten Herzkammer an die Herzmuskulatur ab. Diese Kammerelektroden werden im oberen bzw. mittleren Bereich der Herzscheidewand (Septum interventriculare) verankert, die die rechte von der linken Herzkammer trennt. Die Elektroden selbst führen im Herz nicht zu einer mechanischen Veränderung des Blutstroms.
- Ladegerät: Mit Hilfe des Ladegeräts wird die Stromversorgung des implantierten Pulsgenerators sichergestellt. Aktuelle Batterieladegeräte sind tragbar. Die Patienten können sich während des Ladevorgangs daher weitgehend frei bewegen. Das Ladegerät arbeitet induktiv, kann die Batterie des IPG also berührungs- und kabellos durch die Haut hindurch aufladen. Das Laden wird von den Patienten nach einer Einweisung selbständig zu Hause vorgenommen. Ein Ladevorgang versorgt den Impulsgenerator etwa für eine Woche mit Energie. In dieser Hinsicht unterscheiden sich der Pulsgenerator der kardialen Kontraktilitätsmodulation von Herzschrittmachern und ICD-Geräten, die in der Regel nicht über eine Batterieladefunktion verfügen, sondern operativ ausgetauscht werden, sobald ihre Batterie erschöpft ist.
- Programmiereinheit: Die Programmeinheit steht für die Geräteüberprüfung ausschließlich dem Arzt und – bei technischen Problemen – speziell ausgebildeten Technikern zur Verfügung. Mit der Programmiereinheit kann die Signalabgabe des Impulsgenerators individuell auf die Bedürfnisse des einzelnen Patienten abgestimmt werden. Anpassungen sind unter anderem hinsichtlich der Signalintensität und der Dauer der täglichen Anwendung möglich. Die Programmierung des IPG erfolgt ebenfalls berührungslos per Induktion, kann also problemlos durch die Haut hindurch am implantierten Gerät vorgenommen werden.
Signale
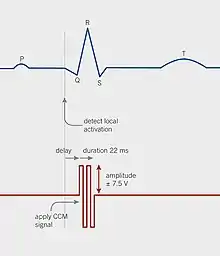
Die kardiale Kontraktilitätsmodulation wirkt über spezielle elektrische Signale, die vom Impulsgenerator erzeugt werden und während der absoluten Refraktärzeit auf die Herzmuskelzellen einwirken. In der Praxis werden heute Signale verwendet, die etwa 30 ms nach Beginn des QRS-Komplexes (normale Gesamt-QRS-Dauer: ≤ 120 ms) einsetzen. Das Signal besteht aus zwei biphasischen Ausschlägen mit einer Spannung von ± 7,7 V und einer Gesamtdauer von etwa 20 ms.[4][11]
Da die Signale während der absoluten Refraktärzeit der Herzmuskelzellen verabreicht werden, lösen sie keine Muskelkontraktionen aus und führen auch nicht zur Aktivierung zusätzlicher Muskelfasern. Ebenso wenig wird die Abfolge der elektrischen und mechanischen Aktivierung im Herzen verändert. Die Signale enthalten etwa 500 Mal mehr Energie als die Signale von Herzschrittmachern und können in einem Elektrokardiogramm (EKG) problemlos erkannt werden.[4][11]
Implantation
Die Implantation des Impulsgenerators und der Elektroden für die Behandlung der kardialen Kontraktilitätsmodulation erfolgt nach dem gleichen Verfahren, das auch bei der Implantation von Herzschrittmachern angewendet wird. Entsprechende Eingriffe werden in Deutschland ca. 100.000 Mal[22] und weltweit etwa 1.000.000 Mal pro Jahr durchgeführt.[23] Die minimalinvasive Operation dauert etwa 40 Minuten und wird in der Regel in örtlicher Betäubung durchgeführt. Die Patienten sollten jedoch nüchtern bleiben, um die Anästhesie und den Eingriff bei Komplikationen notfalls problemlos erweitern zu können.[14]
Zu Beginn der Implantation überprüft der Arzt die Funktion des Impulsgenerators und der Elektroden. Anschließend werden die Elektroden im Herzen positioniert. Die Positionierung der Elektroden wird durch Röntgenaufnahmen und Messung von Spannung und Stromfluss (Elektrodenimpedanz) überprüft.[14]
Sind die Elektroden positioniert, werden sie mit dem Impulsgenerator verbunden. Unterhalb des Schlüsselbeins des Patienten wird eine Tasche zur Aufnahme des Impulsgenerators angelegt. Der IPG wird eingelegt und die Funktion noch einmal geprüft. Sollte der Patient zusätzlich einen Herzschrittmacher oder implantierbaren Kardioverter-Defibrillator tragen, wird sichergestellt, dass sich die Signale der beiden Geräte nicht wechselseitig stören. Abschließend wird die Tasche vernäht und die Wunde verbunden. Im Allgemeinen werden die Patienten noch einige Zeit überwacht, um die ordnungsgemäße Funktion des Geräts sicherzustellen.[14] Da das Gerät nach Abschluss der Wundheilung vollständig von Haut bedeckt ist, sind keine weiteren Vorsichtsmaßnahmen in Hinblick auf Wasserkontakt erforderlich. Die Patienten können – in Abhängigkeit von ihrem Gesundheitszustand – u. a. uneingeschränkt duschen und schwimmen.[24]
Nach der Entlassung wird die Behandlung durch einen niedergelassenen Kardiologen fortgeführt. Kontrolluntersuchungen erfolgen nach wenigen Tagen, nach einigen Wochen sowie anschließend nach Einschätzung des Kardiologen.[14]
Wartung
Abgesehen vom regelmäßigen Aufladen der Gerätebatterie (die Ladezeit beträgt ca. 1 Stunde für eine Woche Betrieb[25]) und dem operativen Austausch der Batterie nach Ablauf der Betriebszeit sind die Geräte der kardialen Kontraktilitätsmodulation wartungsfrei. In gewissen Abständen, die der behandelnde Arzt festlegt, ist jedoch eine Kontrolle der Funktion des Geräts und gegebenenfalls eine Anpassung der Geräteeinstellung durch den Kardiologen vorgesehen.[25] Das Batterieladegerät ist mit einer Warnfunktion ausgestattet, die den Patienten bei Gerätefehlfunktionen oder anderen Funktionsauffälligkeiten wie z. B. einer unzureichenden Signalabgabe darüber informiert, den Arzt aufzusuchen.[26]
Wechselwirkungen mit anderen elektrostimulativen Behandlungen
Störende Wechselwirkungen zwischen der kardialen Kontraktilitätsmodulation und anderen elektrostimulativen Behandlungsverfahren wurden bisher nicht beobachtet. Studien haben ergeben, dass die Therapie problemlos parallel zu einer Herzschrittmacher- und/oder CRT-Behandlung mit oder ohne gleichzeitige Kardioverter-Defibrillator-Behandlung durchgeführt werden kann, ohne dass es zu einer Beeinträchtigung der einzelnen Therapien kommt.[4] Aufgrund dieser Ergebnisse wurde von einigen Medizinern bereits die Entwicklung von kombinierten Geräten der kardialen Kontraktilitätsmodulation und Kardioverter-Defibrillator-Geräten gefordert, um Patienten mit kombinierter Therapie nicht durch mehrere elektrostimulative Geräte und Implantationsoperationen zu belasten.[4][11]
Verordnung und Kostenübernahme
Die Behandlung der kardialen Kontraktilitätsmodulation wird in der Regel durch einen Herzspezialisten empfohlen. Die Implantation erfolgt zumeist durch einen interventionell arbeitenden Kardiologen. Die Kosten der Behandlung werden in Deutschland, der Schweiz, Österreich und Italien sowohl von den Krankenkassen als auch von den Privaten Krankenversicherungen vollständig übernommen.[26]
Wirksamkeit der Behandlung
Die kardiale Kontraktionsmodulation hat sich in randomisierten kontrollierten Studien mit mehreren hundert Teilnehmern als wirksam und sicher erwiesen.[27][28][29]
Art und Umfang der Therapie waren der Gegenstand von zahlreichen Untersuchungen. Obwohl verschiedene Einzelpublikationen und eine von zwei Metastudien die Wirksamkeit und weitreichendes Potential für die Behandlung der Herzinsuffizienz zusprechen, ist die medizinische Bewertung der Wirksamkeit des Verfahrens noch nicht abgeschlossen. Bisher (Stand: Februar 2015) liegen mindestens zwei Metastudien zur Wirksamkeit der kardialen Kontraktilitätsmodulation bei Herzinsuffizienz[3][30], eine größere Zahl Übersichtsartikel zur Therapie (z. B.[4][13][14][31][9]) sowie mindestens zwei Überblicksartikel zum Einsatz apparativer Behandlungsformen bei fortgeschrittener Herzinsuffizienz[2][11] vor, die auf die kardiale Kontraktilitätsmodulation eingehen. Darüber hinaus existieren mehr als 70 Einzelveröffentlichungen, die sich schwerpunktmäßig mit der Therapie befassen.[32]
Weitere randomisierte kontrollierte Studien zur Auswirkung der kardialen Kontraktilitätsmodulation auf das Fortschreiten (Progression) der Herzinsuffizienz sind angestoßen worden und rekrutieren derzeit Patienten.[10] Wissenschaftler weisen darauf hin, dass eine ähnliche Studienlage auch zu Beginn der Einführung der heute etablierten CRT-Behandlung bestand, und befürworten, die kardiale Kontraktilitätsmodulation geeigneten Patienten bereits vor Abschluss der entsprechenden Studien zur Verfügung zu stellen.[4][13]
Metastudien
Giallauria, Vigorito, Piepoli, Coats 2014:[3] Giallauria, Coats sowie weitere Kollegen werteten die drei bisher vorliegenden randomisierten kontrollierten Studien (RCT) zur Behandlung von Herzinsuffizienz-Patienten mit der kardialen Kontraktilitätsmodulation aus. Die drei Studien schlossen insgesamt 641 Patienten ein, die die Wirkung der Therapie entweder im Vergleich zu einer Scheinbehandlung[27][28] oder im Vergleich zu einer optimalen medikamentösen Therapie bewerteten.[29] Im Gegensatz zu einer früheren Metastudie von Kwong und Kollegen[30] werteten sie die Studiendaten nicht auf Grundlage der zusammenfassenden Ergebnisse, sondern anhand der individuellen Behandlungsresultate der 641 eingeschlossenen Patienten aus.
Dabei kamen sie zu dem Ergebnis, dass die kardiale Kontraktilitätsmodulation wichtige Marker der Herzleistung verbessert. Dazu gehören die sogenannte maximale Sauerstoffaufnahme im Herz und Lunge (erfasst mittels kardiopulmonalem Belastungstest: peak VO2 oder pVO2), die auf ein längeres Überleben der Krankheit hinweist[33], und das Ergebnis im sogenannten 6-Minuten-Gehtest. Ebenso wurde die Lebensqualität der Patienten, gemessen über den Minnesota Living with Heart Failure Questionnaire (MLWHFQ), signifikant verbessert. Beide Metastudien forderten jedoch zusätzliche und umfangreichere randomisierte kontrollierte Studien, um die Wirkung der kardialen Kontraktilitätsmodulation besser einschätzen zu können.
Giallauria et al. heben den Erfolg und das weitergehende Potential der kardialen Kontraktilitätsmodulation hervor. Dabei wird insbesondere darauf hingewiesen, dass die Therapie die bestehende therapeutische Lücke der Herzinsuffizienz-Behandlung – den bisherigen Studienergebnissen zufolge – eventuell schließen könnte.
Langzeit-Überlebensstudien
Bisher (Stand: Februar 2015) sind die Auswirkungen der Therapie auf die langfristige Sterblichkeit von Herzinsuffizienz-Patienten noch nicht in randomisiert-kontrollierten Studien untersucht worden. Es wurden jedoch einige vorläufige Ergebnisse von Single-Center-Studien veröffentlicht.[8]
Kuschyk et al. untersuchten die langfristige Wirksamkeit und die Überlebenswahrscheinlichkeit von Herzinsuffizienz-Patienten, die die kardiale Kontraktilitätsmodulation erhielten.[8] Ihre Studie erfasste 81 Patienten mit einer Erkrankungsschwere der NYHA-Klassen II, III und IV über einen durchschnittlichen Beobachtungszeitraum von 3 Jahren. Die Auswertung verglich die beobachtete Sterblichkeit mit den Vorhersagen des Meta-analysis Global Group in Chronic Heart Failure (MAGGIC)-Modells, das auf der Auswertung der Krankenakten von 39.000 Herzinsuffizienz-Patienten beruht.[34][35] Im Unterschied zu einer früheren Langzeit-Untersuchung zum Erfolg der kardialen Kontraktilitätsmodulation[36] wurde die Aussagekraft der Untersuchung von Kuschyk et al. nicht durch eine zu große Heterogenität der Patientengruppe eingeschränkt.[8]
Aufgrund der Langzeit-Beobachtung kam die Studie zu dem Ergebnis, dass die kardiale Kontraktilitätsmodulation die Lebensqualität, physische Belastbarkeit, die NYHA-Klasse (Erkrankungsschwere), die linksventrikuläre Ejektionsfraktion (LVEF) und das Brain Natriuretic Peptide (BNP; ein Hormon, das bei Dehnung der Herzmuskelzellen abgesondert wird) verbessert. Die beobachtete Sterblichkeit der mit der Therapie behandelten Patienten erwies sich nach einem Jahr als signifikant niedriger als aufgrund der MAGGIC-Daten erwartet. Ein gleichartiger Trend zeigte sich auch drei Jahre nach Studienbeginn, erreichte jedoch keine Signifikanz.
Einzelstudien
Häufig zitierte[2][3][11][13][14][17][37][19] Untersuchungen zur kardialen Kontraktilitätsmodulation sind u. a.:
- FIX-HF-3 (Stix et al. 2004)[38]: Diese Untersuchung war die erste umfangreichere Erprobung der Therapie am Menschen. In die prospektive Studie wurden 25 Patienten aufgenommen. Die Ergebnisse zeigten, dass die elektrischen Signale die systolische Funktion und klinische Parameter verbessern konnten.
- USA FEASIBILITY RCT FIX-HF-5-I (Neelagaru et al. 2006):[27] Diese Untersuchung war eine prospektive doppelt verblindete prospektive Machbarkeits- und Sicherheitsstudie, die in den USA durchgeführt wurde und 49 Patienten einschloss. Die Studie erbrachte grundlegende Daten zur Sicherheit der Therapie.
- Butter et al. 2007[39]: Diese prospektive Kurzzeittherapie-Studie an 9 Patienten und 6 Hunden zeigte, dass die Verbesserung der Funktion der linken Herzkammer durch die kardiale Kontraktilitätsmodulation erreicht wird, ohne den Sauerstoffverbrauch des Herzmuskels zu erhöhen.
- Nagele et al. 2008:[15] In dieser Studie wurde die Therapie als zusätzliche Maßnahme bei Patienten eingesetzt, die auf eine CRT-Behandlung nicht angesprochen hatten (CRT-Non-Responder). Die Untersuchung zeigte, dass die Behandlung die Belastbarkeit und Lebensqualität von CRT-Non-Respondern verbesserte.
- EUROPEAN RCT FIX-HF-4 (Borggrefe et al. 2008):[28] Diese prospektive doppelblinde Crossover-Studie schloss etwa 160 Patienten ein und erbrachte den ersten definitiven Beleg für die Sicherheit und Wirksamkeit von den Geräten der kardialen Kontraktilitätsmodulation. Der Begriff Crossover bedeutet, dass die Studienteilnehmer nacheinander für gleiche Zeiträume beide zu vergleichenden Behandlungsoptionen mit der kardialen Kontraktilitätsmodulation durchliefen. Die Wirkung der kardialen Kontraktilitätsmodulation auf die Lebensqualität und die Belastungstoleranz war vergleichbar mit dem der CRT.
- FIX-HF-9 (Yu et al. 2009):[6] Bei dieser klinischen Untersuchung handelte es sich um eine prospektive, doppelblinde Langzeitstudie an 30 Patienten. Sie zeigte, dass die kardiale Kontraktilitätsmodulation zu einer Verbesserung der Funktion der linken Herzkammer und zum Rückumbau krankhafter Veränderungen am Herzen (reverses Remodeling) führte.
- USA RCT FIX-HF-5-II (Kadish et al. 2011):[29] Für diese prospektive randomisierte Studie wurden 428 Patienten rekrutiert. Die Ergebnisse zeigten, dass die kardiale Kontraktilitätsmodulation sicher ist, den prognostisch auf eine geringere Krankheitsschwere und Sterblichkeit hinweisenden[40] maximalen Sauerstoffverbrauch im kardiopulmonalen Belastungstest – peak VO2 (pVO2) –, der ein Indikator für eine längere Überlebenszeit der Patienten ist, erhöht und die Lebensqualität, erfasst über den Minnesota Living With Heart Failure Questionnaire (MLWHFQ), in der Zielgruppe verbesserte.
- Abraham et al. 2011:[12] Diese Studie war eine retrospektive Subgruppen-Analyse der Daten der FIX-HF-5-II-Studie (s. o.). Die Untersuchung identifizierte eine Untergruppe von Patienten, in der die kardiale Kontraktilitätsmodulation zu einer signifikanten Verbesserung der anaeroben Schwelle und weiterer Parameter führte. Diese Untergruppe war durch eine normale QRS-Zeit, Symptome entsprechend NYHA-Klasse III und eine linksventrikuläre Ejektionsfraktion (LVEF) > 25 % charakterisiert.
Nebenwirkungen
Die im Rahmen der kardialen Kontraktilitätsmodulation am häufigsten beobachtete Nebenwirkung ist der Bruch oder die Verlagerung der Elektroden.[29]
Darüber hinaus traten auf:
- Infektion und Blutungen an der Implantationsstelle des Impulsgenerators
- Flüssigkeitsansammlungen im Herzbeutel[28]
Diese Nebenwirkungen unterscheiden sich nicht von denen, die bei elektrostimulativen Behandlungsverfahren (Herzschrittmacher, sonstige CRT, ICD) auftreten.[33] Weiterhin bestand hinsichtlich der Nebenwirkungen kein Unterschied zwischen aktiviertem und deaktiviertem Behandlungsgerät.[13] Insgesamt konnte statistisch keine negative Auswirkung der Behandlung auf Gesundheitsmarker nachgewiesen werden.[13]
Die Behandlung im Alltag
Allgemeines
Die Herzinsuffizienz ist eine chronische Erkrankung, die in ihrem Verlauf zumeist fortschreitet.[16] Dabei treten bei den betroffenen Patienten individuell unterschiedliche und unterschiedlich schwere Verläufe und Beschwerden auf. Die kardiale Kontraktilitätsmodulation ist auf mittel- bis langfristige Behandlungserfolge im Verlauf von Wochen und Monaten ausgerichtet. Entsprechend müssen sich betroffene Patienten dauerhaft auf ein Leben mit der Behandlung einstellen.
Nach Angaben großer Implantationskliniken unterscheidet sich das Alltagsleben mit der kardialen Kontraktilitätsmodulation nach Abschluss der Wundheilung jedoch kaum vom Leben vor der Implantation.[40] Freizeitgestaltung, Reisen, Hobbys und Sexualleben können unverändert fortgeführt werden. Bei Ansprechen der Therapie besteht jedoch die Möglichkeit, dass die Patienten eine verbesserte Belastbarkeit bei diesen Aktivitäten wahrnehmen.
Vorsichtsmaßnahmen

- Elektromagnetische Felder: Starke elektromagnetische Felder können die Funktion des Geräts vorübergehen stören. Nach Abklingen der Störsignale oder bei hinreichendem Abstand nimmt das Gerät in den meisten Fällen die normale Funktion wieder auf. Die elektromagnetischen Felder von Haushaltsgeräten gelten im Allgemeinen als unbedenklich.[41]
- Mobiltelefone: Zwischen dem Gerät und Mobiltelefonen wird ein Sicherheitsabstand von 10–15 cm empfohlen. Davon abgesehen bestehen keine Einschränkungen hinsichtlich der Verwendung von Mobiltelefonen.[41]
- Sicherheitskontrollen: Ganzkörper Metalldetektoren, wie sie z. B. an Flughäfen verwendet werden, beeinflussen die Funktion des -Geräts in der Regel nicht. Dennoch finden sich oft Warnhinweise für Träger von Herzschrittmachern und Defibrillatoren. In diesen Fällen wird den Patienten empfohlen, ihren Geräteausweis vorzulegen. Die Kontrolle erfolgt dann zumeist mit Handgeräten oder durch manuelles Abtasten. Die Handgeräte dürfen bei der Kontrolle jedoch nicht rasch hintereinander mehrfach über das Implantat geführt werden, da es sonst zu Funktionsaussetzern kommen kann.[42]
- Sport: Zumeist nicht mehr möglich sind alle Sportarten, die mit vermehrter Belastung der Arme oder des Brustbereichs einhergehen wie z. B. Kraft- und Kampfsport, aber auch Tennis. Tauchen ist aufgrund des zunehmenden Wasserdrucks nur bis zu einer Tauchtiefe von 5 m zulässig.[43]
- Magnetresonanztomografie (MRT, Kernspintomografie): Patienten mit implantierten elektrostimulativen Geräten der kardialen Kontraktilitätsmodulation, Herzschrittmachern oder ICDs dürfen nicht mittels Magnetresonanztomografie untersucht werden.[44]
Geschichte
Die Entwicklung der kardialen Kontraktilitätsmodulation begann gegen Ende der 1990er Jahre.[45][46] In Untersuchungen an einzelnen Herzmuskelzellen mittels Patch-Clamp-Technik (Diese Technik wurde erstmals 1976 von Erwin Neher und Bert Sakmann beschrieben.) hatte sich bereits 1969 gezeigt, dass eine während der absoluten Refraktärzeit der Zelle mittels Elektroden zwischen Zellinnen- und Zellaußenraum angelegte elektrische Spannung einen vermehrten Kalzium-Einstrom durch die Zellmembran von Herzmuskelzellen und eine verbesserte Verkürzbarkeit (Kontraktion) der Muskelzelle bewirkte.[47][48] 2001 konnte nachgewiesen werden, dass ein entsprechender Effekt auch bei ausschließlich außerhalb der Herzmuskelzellen anliegender Spannung eintritt.[49] Zusätzlich wurde beobachtet, dass therapeutisch nutzbare Wirkungen am Herzmuskel auch dann auftraten, wenn die elektrischen Signale nicht nur einzelne Zellen erreichten, sondern mittels makroskopischer Elektroden, wie sie etwa bei Herzschrittmachern eingesetzt werden, großflächig abgegeben wurden. Durch die Applikation geeigneter Signale während der absoluten Refraktärzeit der Herzmuskelzellen konnte die Kontraktilität sowohl von gesunden als auch von geschädigten Herzen verbessert werden.[49][50]
Die erste Behandlung eines Menschen mit der kardialen Kontraktilitätsmodulation erfolgte im Jahr 2001.[51][52] Die erste Studie zu therapeutischen Effekten beim Menschen wurde 2004 vorgelegt.[38] Weltweit wurden bisher (Stand: Februar 2015) mehr als 2.000 Geräte implantiert,[9] darunter 641 Patienten unter Studienbedingungen, die gemäß den Empfehlungen der Cochrane Collaboration qualitativ die Voraussetzungen für die Aufnahme in eine Metastudie erfüllten.[3]
Siehe auch
Weblinks
- Aktuelle Einschätzung zu neuen Gerätetherapien bei Herzinsuffizienz. (PDF; englisch) European Heart Rhythm Association (EHRA); behandelt umfassend auch die kardiale Kontraktilitätsmodulation
Einzelnachweise
- William T. Abraham, Karl-Heinz Kuck, Rochelle L. Goldsmith, JoAnn Lindenfeld, Vivek Y. Reddy: A Randomized Controlled Trial to Evaluate the Safety and Efficacy of Cardiac Contractility Modulation. In: JACC: Heart Failure. Band 6, Nr. 10, Oktober 2018, S. 874–883, doi:10.1016/j.jchf.2018.04.010 (elsevier.com [abgerufen am 3. November 2019]).
- W.T. Abraham, S.A. Smith: Devices in the management of advanced, chronic heart failure. In: Nat Rev Cardiol. 10, Nr. 2, Februar 2013, S. 98–110. doi:10.1038/nrcardio.2012.178. PMID 23229137. PMC 3753073 (freier Volltext).
- F. Giallauria, et al.: Effects of cardiac contractility modulation by non-excitatory electrical stimulation on exercise capacity and quality of life: an individual patient’s data meta-analysis of randomized controlled trials. In: Int J Cardiol. 175, Nr. 2, August 2014, S. 352–357. doi:10.1016/j.ijcard.2014.06.005. PMID 24975782.
- M. Borggrefe, D. Burkhoff: Clinical effects of cardiac contractility modulation (CCM) as a treatment for chronic heart failure. In: Eur J Heart Fail. 14, Nr. 7, Juli 2012, S. 703–712. doi:10.1093/eurjhf/hfs078. PMID 22696514.
- C. Butter, et al.: Cardiac Contractility Modulation Electrical Signals Improve Myocardial Gene Expression in Patients With Heart Failure. In: J Am Coll Cardiol. 51, Nr. 18, Mai 2008, S. 1784–1789. doi:10.1016/j.jacc.2008.01.036. PMID 18452785.
- C.M. Yu, et al.: Impact of cardiac contractility modulation on left ventricular global and regional function and remodeling. In: JACC Cardiovasc Imaging. 2, Nr. 12, Dezember 2009, S. 1341–1349. doi:10.1016/j.jcmg.2009.07.011. PMID 20083066.
- T. Tönnis, K.-H. Kuck: Therapie der chronischen Herzinsuffizienz durch kardiale Kontraktionsmodulation (CCM) Möglichkeiten und Studienübersicht. In: Herz. 36, Nr. 7, Oktober 2011, S. 600–607. doi:10.1007/s00059-011-3510-z. PMID 21912910.
- J. Kuschyk, S. Roeger u. a.: Efficacy and survival in patients with cardiac contractility modulation: Long-term single center experience in 81 patients. In: International journal of cardiology. [elektronische Veröffentlichung vor dem Druck] Januar 2015, ISSN 1874-1754, doi:10.1016/j.ijcard.2014.12.178, PMID 25662055.
- J. Kuschyk: Der Besondere Stellenwert der Kardialen Kontraktilitätsmodulation in der Devicetherapie. In: Herzmedizin. 2014.
- clinicaltrials.gov
- K.-H. Kuck, et al.: New devices in heart failure: an European Heart Rhythm Association report: developed by the European Heart Rhythm Association; endorsed by the Heart Failure Association. In: Europace. 16, Nr. 1, Januar 2014, S. 109–128. doi:10.1093/europace/eut311. PMID 24265466.
- W.T. Abraham, et al.: Subgroup Analysis of a Randomized Controlled Trial Evaluating the Safety and Efficacy of Cardiac Contractility Modulation in Advanced Heart Failure. In: J Card Fail. 17, Nr. 9, September 2011, S. 710–717. doi:10.1016/j.cardfail.2011.05.006. PMID 21872139.
- D. Burkhoff: Does Contractility Modulation Have a Role in the Treatment of Heart Failure?. In: Curr Heart Fail Rep. 8, Nr. 4, Dezember 2011, S. 260–265. doi:10.1007/s11897-011-0067-3. PMID 21656201.
- C. Butter: Verbesserung der linksventrikulären Kontraktilität durch Stimulation in der absoluten Refraktärperiode. Kardiale Kontraktilitätsmodulation.. In: Herzschr Elektrophys. 22, Nr. 1, März 2011, S. 27–33. doi:10.1016/j.jacc.2008.01.036. PMID 21365468.
- H. Nagele, S. Behrens, C. Eisermann: Cardiac contractility modulation in non-responders to cardiac resynchronization therapy. In: Europace. 10, Nr. 12, Dezember 2008, S. 1375–1380. doi:10.1093/europace/eun257. PMID 18776196. Abgerufen am 11. Oktober 2014.
- J.J.V. McMurray, et al.: ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. In: European Heart Journal. 33, Nr. 14, 2012, S. 1787–1847. doi:10.1093/eurheartj/ehs104. PMID 22828712. Abgerufen am 10. Oktober 2014.
- S. Röger, et al.: Long term impact of cardiac contractility modulation on QRS duration. In: J Electrocardiol. August 2014. doi:10.1016/j.jelectrocard.2014.08.011. PMID 25201417.
- Acute and Chronic Heart Failure. Abgerufen am 22. November 2017.
- S. Röger, et al.: Cardiac contractility modulation: first experience in heart failure patients with reduced ejection fraction and permanent atrial fibrillation. In: Europace. April 2014. doi:10.1093/europace/euu050. PMID 24706089.
- A.R. Lyon, M.A. Samara, D.S. Feldman: Cardiac contractility modulation therapy in advanced systolic heart failure. In: Nat. Rev. Cardiol.. 10, Nr. 10, Oktober 2013, S. 584–598. doi:10.1038/nrcardio.2013.114. PMID 23939481.
- M. Imai, et al.: Therapy with cardiac contractility modulation electrical signals improves left ventricular function and remodeling in dogs with chronic heart failure. In: J Am Coll Cardiol. 49, Nr. 21, Mai 2007, S. 2120–2128. doi:10.1016/j.jacc.2006.10.082. PMID 17531662. Abgerufen am 11. Oktober 2014.
- K.-H. Kuck, et al.: EHRA White Book 2014 Archiviert vom Original am 17. Dezember 2014. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: The EHRA White Book. Februar, S. 203. Abgerufen am 6. November 2014.
- H.G. Mond, A. Proclemer: The 11th world survey of cardiac pacing and implantable cardioverter-defibrillators: calendar year 2009--a World Society of Arrhythmia’s project. In: Pacing Clin Electrophysiol. 34, Nr. 8, August 2011, S. 1013–1027. doi:10.1111/j.1540-8159.2011.03150.x. PMID 21707667.
- Living With Your Pacemaker. Tips by the American Heart Association
- J. Kuschyk, S. Röger, M. Borggrefe: Kardiale Kontraktilitätsmodulation zur Behandlung der symptomatischen Herzinsuffizienz. In: Der Kardiologe. 8, Nr. 5, Oktober 2014, S. 407–414. doi:10.1007/s12181-014-0595-7.
- Announcement of the launch of the OPTIMIZER IVs CCM device on Implantable-Device.com
- S.B. Neelagaru, et al.: Nonexcitatory, cardiac contractility modulation electrical impulses: Feasibility study for advanced heart failure in patients with normal QRS duration. In: Heart Rhythm. 3, Nr. 10, Oktober 2006, S. 1140–1147. doi:10.1016/j.hrthm.2006.06.031. PMID 17018340.
- M. Borggrefe, et al.: Randomized, double blind study of non-excitatory, cardiac contractility modulation electrical impulses for symptomatic heart failure. In: Eur Heart J. 29, Nr. 8, April 2008, S. 1019–1028. doi:10.1093/eurheartj/ehn020. PMID 18270213. Abgerufen am 16. Oktober 2014.
- A. Kadish, et al.: A randomized controlled trial evaluating the safety and efficacy of cardiac contractility modulation in advanced heart failure. In: Am Heart J. 161, Nr. 2, Februar 2011, S. 329–337. doi:10.1016/j.ahj.2010.10.025. PMID 21315216.
- J.S. Kwong, J.E. Sanderson, C.M. Yu: Cardiac contractility modulation for heart failure: a meta-analysis of randomized controlled trials. In: Pacing Clin Electrophysiol. 35, Nr. 5, September 2012, S. 1111–1118. doi:10.1111/j.1540-8159.2012.03449.x. PMID 22734676.
- J. Kuschyk, M. Borggrefe: Elektrische Therapie der Herzinsuffizienz. In: Kardio up. 9, Nr. 1, 2013, S. 37–56. doi:10.1055/s-0032-1326192. Abgerufen am 6. November 2014.
- Recherche nach dem Suchbegriff „Cardiac Contractility Modulation“ im Titel von Veröffentlichungen in der Pubmed-Datenbank, durchgeführt am 16. Oktober 2014.
- S. Pakarinen, L. Oikarinen, L. Toivonen: Short-term implantation-related complications of cardiac rhythm management device therapy: a retrospective single-centre 1-year survey. In: Europace. 12, Nr. 1, Januar 2010, S. 103–108. doi:10.1093/europace/eup361. PMID 19914920. Abgerufen am 6. November 2014.
- S.J. Pocock, et al.: Predicting survival in heart failure: a risk score based on 39 372 patients from 30 studies. In: Eur Heart J. 34, Nr. 19, Mai 2013, S. 1404–1413. doi:10.1093/eurheartj/ehs337. PMID 23095984. Abgerufen am 20. Februar 2015.
- „MAGGIC“ Heart Failure Risc Calculator (Herzinsuffizienz-Risiko-Rechner) nach Pocock et al. Predicting survival in heart failure: a risk score based on 39 372 patients from 30 studies, Eur Heart J (2013) 34(19) 1404–1413
- T. Schau, et al.: Long-term outcome of cardiac contractility modulation in patients with severe congestive heart failure. In: Europace. 13, Nr. 10, April 2011, S. 1436–1444. doi:10.1093/europace/eur153. PMID 21712286. Abgerufen am 20. Februar 2015.
- A.J.S. Coats, L.G. Shewan: Inconsistencies in the development of the ESC Clinical Practice Guidelines for Heart Failure. In: Int J Cardiol. 168, Nr. 3, Oktober 2013, S. 1724–1727. doi:10.1016/j.ijcard.2013.05.045. PMID 23735338.
- G. Stix, et al.: Chronic electrical stimulation during the absolute refractory period of the myocardium improves severe heart failure. In: Eur Heart J. 25, Nr. 8, April 2004, S. 650–655. doi:10.1016/j.ehj.2004.02.027. PMID 15084369. Abgerufen am 10. Oktober 2014.
- C. Butter, et al.: Enhanced inotropic state of the failing left ventricle by cardiac contractility modulation electrical signals is not associated with increased myocardial oxygen consumption. In: J Card Fail. 13, Nr. 2, März 2007, S. 137–142. doi:10.1016/j.cardfail.2006.11.004. PMID 17395055.
- Informationen der Kerckhoff Klinik zum Alltag mit Herzschrittmachern und Defibrillatoren (Memento des Originals vom 7. Dezember 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (aufgrund der Ähnlichkeit der Geräte gelten die aufgeführten Hinweise auch auf Patienten mit CCM-Geräten)
- Schrittmacher und Geräte-Abstand. Deutsche Herzstiftung; abgerufen am 10. Februar 2015
- Mit Herzschrittmacher im Urlaub. Deutsche Herzstiftung; abgerufen am 10. Februar 2015
- Herzschrittmacher und Sport. Deutsche Herzstiftung; abgerufen am 10. Februar 2015
- T. Dill: Contraindications to magnetic resonance imaging Archiviert vom Original am 2. April 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Heart. 94, Nr. 7, Juli 2008, S. 943–948. doi:10.1136/hrt.2007.125039. PMID 18552230. Abgerufen am 22. Februar 2015.
- Patent for CCM: Apparatus and method for controlling the delivery of contractility modulating non-excitatory signals to the heart
- S. Mohri, et al.: Cardiac contractility modulation by electric currents applied during the refractory period Archiviert vom Original am 14. August 2017. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Am J Physiol Heart Circ Physiol. 282, Nr. 5, Mai 2002, S. H1642–H1647. doi:10.1152/ajpheart.00959.2001. PMID 11959626. Abgerufen am 9. Oktober 2014.
- H. Antoni, R. Jacob, R. Kaufmann: Mechanical response of the frog and mammalian myocardium to changes in the action potential duration by constant current pulses. In: Pflugers Arch. 306, Nr. 1, 1969, S. 33–57. PMID 4975967.
- E.H. Wood, R.L. Heppner, S. Weidmann: Inotropic effects of electric currents. I. Positive and negative effects of constant electric currents or current pulses applied during cardiac action potentials. II. Hypotheses: calcium movements, excitation-contraction coupling and inotropic effects.. In: Circ Res. 24, Nr. 3, März 1969, S. 409–445. doi:10.1161/01.RES.24.3.409. PMID 5766519. Abgerufen am 9. Oktober 2014.
- D. Burkhoff, et al.: Electric currents applied during the refractory period can modulate cardiac contractility in vitro and in vivo. In: Heart Fail Rev. 6, Nr. 1, Januar 2001, S. 27–34. PMID 11248765.
- H.N. Sabbah, et al.: Cardiac contractility modulation with the impulse dynamics signal: studies in dogs with chronic heart failure. In: Heart Fail Rev. 6, Nr. 1, Januar 2001, S. 45–53. PMID 11248767.
- C. Pappone, et al.: Electrical modulation of cardiac contractility: clinical aspects in congestive heart failure. In: Heart Fail Rev. 6, Nr. 1, Januar 2001, S. 55–60. PMID 11248768.
- C. Pappone, et al.: Cardiac contractility modulation by electric currents applied during the refractory period in patients with heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. In: Am J Cardiol. 90, Nr. 12, Dezember 2002, S. 1307–1313. PMID 12480039.