Implantierbarer Kardioverter-Defibrillator
Ein implantierbarer Kardioverter/Defibrillator (ICD, frühere Bezeichnung AICD, von [automatic] implantable cardioverter-defibrillator) ist ein miniaturisiertes automatisches Elektrogerät, das Patienten mit hohem Risiko für lebensbedrohliche Herzrhythmusstörungen mittels einer Operation eingesetzt wird.

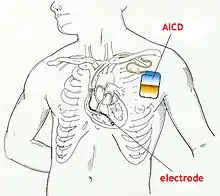
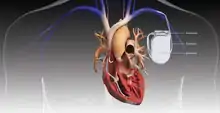
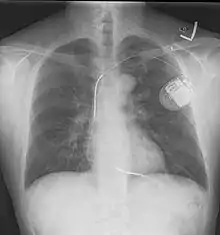
Die Elektroden des ICD liegen in der Herzkammer und haben dadurch direkten Kontakt zum Herzmuskel. Bei Herzkammerflattern oder -flimmern wird automatisch ein elektrischer Impuls ausgelöst. Durch diesen Stromstoß normalisiert sich die Herzmuskelaktivität und damit die lebenswichtige Pumpleistung des Organs. Das Gerät wird wie ein Herzschrittmacher implantiert. Eine Weiterentwicklung des ICD ist der subkutan implantierbare Defibrillator (S-ICD).
ICD werden in Deutschland pro Jahr mit einer Häufigkeit von ca. 270 Implantationen pro einer Million Einwohner neu eingesetzt (Stand: 2019). Diese Zahl wird als europa- sowie als wahrscheinlich weltweit führend angenommen. Zum Vergleich: die Häufigkeit in der Schweiz liegt bei lediglich 137 Neuimplantationen im Jahr auf einer Million Einwohner.[1]
Geschichte
Die Ärzte Michel Mirowski und Morton Mower begannen im Juli 1969 am Sinai Hospital in Baltimore mit der Entwicklung des ICD.[2] Ein erster Prototyp wurde aus dem abgebrochenen Paddle eines externen Defibrillators gebaut und an einem Hund getestet. Der erfolgreiche Versuch wurde von der Fachwelt mit Interesse zur Kenntnis genommen. Jedoch wurde das Vorhaben Mirowskis und Mowers, ein internes batteriegespeistes System zur Defibrillation und Kardioversion für den Menschen zu entwickeln, von den damaligen Experten skeptisch betrachtet. Das führte dazu, dass sich der bisherige Sponsor Medtronic von den weiteren Plänen der Erfinder distanzierte und nicht mehr unterstützte.
Mirowski und Mower kamen 1972 in Kontakt mit Stephen Heilman, dem Gründer des noch kleinen Medizintechnik-Unternehmens Medrad. Heilman war von dem ICD-Projekt überzeugt und stellte den Medizinern die Ingenieure seiner Firma zur Verfügung, unter ihnen Alois Langer. Als es 1975 gelang, einen Defibrillator vollständig in einen Hund zu implantieren, wurde die kardiologische Forschung wieder auf die Innovation aufmerksam. Ziel war nun, ein Gerät zu produzieren, das einem Menschen eingesetzt werden konnte.
Dieses Ziel wurde am 4. Februar 1980 erreicht; im Johns Hopkins Hospital in Baltimore wurde die Implantation eines ICD vom Herzchirurgen Levi Watkins erfolgreich an einer 57-jährigen Frau durchgeführt, die bis dahin an schweren, medikamentös nicht kontrollierbaren Herzrhythmusstörungen litt. Für den Eingriff musste allerdings der Brustkorb eröffnet werden, um die Elektroden zu platzieren. Außerdem war das Gerät noch relativ schwer (225 g) und noch nicht in der Lage, andere Aktionen als das Beenden von Kammerflimmern auszulösen.[3]
In den folgenden Jahren verfeinerte das Team um Mirowski und Mower das System, das 1985 die Zulassung der Food and Drug Administration (FDA) erhielt. Seit Ende der 1980er Jahre kann ein ICD ohne Thorakotomie implantiert werden und verfügt über weitere Funktionen wie die synchronisierte Kardioversion.
Die Klassifikation der (A)ICD-Systeme folgte dann dem NBD-Code (vgl. NBG-Code), wobei die erste Stelle die Schockkammer, die zweite die antitachykarde Stimulationskammer, die dritte die Art der Tachykardiedetektion und die vierte Stelle die antibradykarde Stimulationskammer angibt.[4]
Systeme, Bestandteile und Funktionsweise
Konventioneller ICD
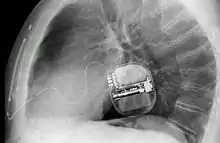
Ein ICD besteht im Prinzip aus zwei Komponenten. Einerseits dem ICD-Gerät, das aus der Steuerung, einer Batterie und einer Elektrode besteht, und einer venösen Elektrode, die in der rechten Herzkammer verankert wird. Der ICD wird unter der Haut vor oder in dem linken Brustmuskel implantiert. Der Diagnostikteil erkennt durch permanente EKG-Ableitung behandlungsbedürftige Störungen, der Stimulationsteil löst daraufhin den Stromstoß aus. Beim Schock wird ein elektrisches Feld aufgebaut.[5] Bei modernen Geräten kann dieses entweder zwischen der venösen Elektrode und dem Gehäuse des ICD-Geräts aufgebaut werden oder aber bei Verwendung sogenannter Dual-Coil-Elektroden (wie auf dem abgebildeten Röntgenbild) zwischen zwei getrennten Spulen einer venösen Elektrode. So kann je nach individueller Anatomie das elektrische Feld mit dem Ziel optimiert werden, möglichst viel Herzmuskelgewebe im elektrischen Feld zu erfassen.[6]
Das Gehäuse eines ICD besteht aus gewebeverträglichem Titan. Darin sind ein Mikrocomputer mit elektronischem Schaltkreis und eine langlebige Batterie eingekapselt. An der Oberseite befinden sich Anschlüsse für die Sonden (Elektroden), die in das rechte Herz geführt werden. Die Herzsignale werden ständig von Messfühlern, die sich an den Enden der Sonden befinden, an den Mikrocomputer des ICDs weitergeleitet. Werden die eintreffenden Signale vom Computerprogramm als Kammerflattern oder -flimmern identifiziert, leitet eine integrierte Defibrillationselektrode schockartige Impulse in die Herzkammer, bis sich der Herzrhythmus auf die programmierten Normwerte stabilisiert hat.
Subkutaner ICD
Während beim konventionellen ICD die Spitze der intravenösen Elektrode direkt in die Herzkammer vorgeschoben werden muss, was eine Durchleuchtung erfordert, entfällt dies bei der Einlage eines subkutanen ICDs. Dessen Elektroden werden unter der Haut in eine Region neben dem Brustbein platziert. So ist die Implantation einfacher und ohne Strahlenbelastung möglich. Auch ein vermindertes Infektionsrisiko und die fehlenden Komplikationen der transvenösen Elektroden sprechen für diese Variante.[7]
Es sind im Vergleich zum konventionellen ICD stärkere und häufigere Stromstöße erforderlich, um die Arrhythmie des Herzens zu beenden und einen drohenden Herzstillstand zu verhindern. Es fehlt auch die Möglichkeit, antibradykarde Therapie im Sinne einer herkömmlichen Schrittmachertherapie oder antitachykarde Schrittmacherimpulse (Überstimulation einer ventrikulären Tachykardie) abzugeben, da hierfür die ins Herz führenden Elektroden notwendig wären. Trotzdem zeigten die Langzeitstudien die positiven Effekte und Vorteile dieser neuen ICD-Variante für geeignete Patienten.[8]
In Europa sind entsprechende Geräte seit 2009 auf dem Markt. In den USA wurden sie aufgrund strengerer Zulassungsvoraussetzungen 2012 eingeführt.[9]
Diagnostikteil
Der Diagnostikteil des Gerätes ist in der Lage, bedrohliche Rhythmusstörungen zu erkennen (Detektion) und für den überwachenden Arzt aufzuzeichnen. Hierzu existieren eine Vielzahl von Algorithmen, zum Beispiel Plötzlichkeit (onset), Stabilität (stability), QRS-Morphologie (Wavelet oder Rhythm ID), AV-Synchronität (V>A). Alle modernen Systeme haben EKG-Speicher zur Aufzeichnung der Episoden. Die Detektionsalgorithmen erkennen nahezu 100 % aller Herzkammertachykardien, die Spezifität liegt mit 80–90 % etwas niedriger. In manchen Fällen erkennt das Gerät daher fälschlicherweise Kammerflimmern, obwohl keine Rhythmusstörung vorliegt, und gibt einen sogenannten inadäquaten Schock ab. Ein solcher Schock kann auch durch einen technischen Defekt ausgelöst werden.[10][11] Für den Patienten ist ein inadäquater Schock besonders unangenehm, da er sich dabei in der Regel bei vollem Bewusstsein befindet.[12]
Therapieteil
Es sind aktuell drei Funktionen zu unterscheiden:
- Schockabgabe (DC-Schock) bei erkanntem Kammerflimmern oder ineffektiver Überstimulation.
- Überstimulation (ATP= antitachykardes pacing) zum Beenden stabiler ventrikulärer Tachykardien, die durch kreisende Erregungen (reentry) verursacht werden.
- Normale (antibradykarde) Schrittmacherstimulation, auch als Resynchronisationstherapie bei schwerer Herzinsuffizienz mit Linksschenkelblock. (Dreikammer-ICD)
Programmierung und Überwachung des ICD
Die Programmierung erfolgt durch einen Facharzt für Kardiologie über Telemetrie. Dazu wird ein Programmierkopf auf die Implantationsstelle gelegt, der wiederum durch ein Kabel mit dem Programmiergerät verbunden ist. Zur Programmierung gehört unter anderem die Aktivierung eines Signaltones, der eventuelle Störungen des Gerätes anzeigt. Bei der Überprüfung werden gespeicherte Daten abgerufen und ausgewertet. Eventuell wird der ICD daraufhin neu programmiert. Bei Nachsorgeuntersuchungen wird unter anderem der Ladestatus der Batterie überprüft, der abhängig von der Häufigkeit und Stärke der Impulsabgaben ist. Bei modernen Geräten ist die Auflage eines Programmierkopfes zur Herstellung einer Verbindung nicht nötig, es reicht für den Patienten aus sich physisch in der Nähe des zur Programmierung und Auslesung verwendeten Gerätes aufzuhalten.
Interferenzen
Starke Dauermagnete aus Werkstoffen wie Neodym-Eisen-Bor, die beispielsweise in Kopfhörern vorkommen, können Schrittmacher oder auch ICD beeinflussen.[13][14] Darüber hinaus können starke elektromagnetische Wechselfelder, die beispielsweise im Nahbereich durch leistungsstarke Drehstrommotoren erzeugt werden können, einen Einfluss auf die Eingangsfilter des ICD haben und zum sogenannten Oversensing führen.
Inadäquate Schockabgaben
Als inadäquate Schockabgaben werden Schockabgaben auf Grund von Fehlannahmen des ICD-Systems über das Vorliegen einer ventrikulären Tachykardie oder Kammerflimmerns bezeichnet. Hierzu kann es beispielsweise auf Grund externer elektrischer Interferenzen (s. o.) kommen. Bei zu hoher Empfindlichkeit der ventrikulären Wahrnehmung des ICD-Systems kann es auf Grund der Fehlinterpretation der T-Welle als R-Zacke zu sogenanntem T-Wellen-Oversensing kommen, was in Folge zu einer doppelten Zählung einer Herzaktion und so zu einer vermeintlich doppelt so hohen wahrgenommenen Herzfrequenz führt.[6]
Psychische und ethische Problematik
Von einigen Patienten wird eine fast unerträgliche, schmerzhafte Empfindung der Therapieabgaben geschildert („wie ein Griff in die Steckdose“). Wenn mehrere Auslösungen von Elektroschocks dicht aufeinander erfolgen, kann die psychische Belastung enorm hoch sein; in manchen Fällen müssen die Patienten durch Psychologen intensiv betreut werden.[15][16]
Das Gerät kann den Tod durch Herzinsuffizienz oder andere, nicht-kardiale Erkrankungen nicht verhindern. Am Lebensende tritt bei vielen Patienten ein Herzstillstand auf, so dass der ICD nicht ausgelöst wird.[17] Da es in der Sterbephase aber zu Elektrolytverschiebungen und damit zu tachykarden Herzrhythmusstörungen kommen kann, erleben bis zu zwei Drittel der ICD-Patienten und deren Angehörige beziehungsweise das Pflegepersonal unerwünschte und belastende Schockereignisse während der finalen Sterbephase. Ein möglicher palliativer Behandlungsansatz wird dadurch erheblich beeinträchtigt. Um dies zu vermeiden, muss rechtzeitig das Gespräch mit dem Patienten gesucht werden, um mit seinem Einverständnis eine entsprechende Programmierung vorzunehmen oder das Gerät zu deaktivieren, im Notfall durch Auflage eines starken Magneten an der entsprechenden Implantionsstelle.[18][19]
Hersteller
Bedeutende Hersteller von implantierten Defibrillatoren sind:
- Abbott Laboratories (durch Übernahme 2017 von St. Jude Medical)
- Biotronik
- Boston Scientific (übernahm Guidant (Guidant übernahm wiederum früher Sulzer-Intermedics und CPI; Cardiac Pacemakers Inc.))
- LivaNova (einschließlich ehemalige ELA Medical und Sorin Biomedica)
- Medtronic (einschließlich NayaMed)
- Sorin Group
Marktanteile in Deutschland
Von den im Jahr 2015 registrierten 30.002 Implantationen in Deutschland stammen nach Angaben des Deutschen Herzschrittmacher-Registers[20] die Defibrillatoren (ICD-Aggregaten) von folgenden Herstellern:
| Anzahl der ICD | Marktanteile in % | Hersteller |
|---|---|---|
| 10.054 | 33,5 % | |
| 8.586 | 28,6 % | |
| 6.962 | 23,2 % | |
| 4.018 | 13,4 % | |
| 346 | 1,2 % | |
| 36 | 0,1 % | Sonstige |
Einzelnachweise
- Prof. Dr. A. Markewitz: Jahresbericht 2019 des Deutschen Herzschrittmacher- und Defibrillator-Registers Teil 2: Implantierbare Cardioverter-Defibrillatoren (ICD). Hrsg.: Deutsche Gesellschaft für Kardiologie – Herz- und Kreislaufforschung e.V.; Mitglieder der Bundesfachgruppe Herzschrittmacher.
- S. Mahapatra: History of Cardiac Pacing. In: I. R. Efimov, M. W. Kroll, P. Tchou (Hrsg.): Cardiac Bioelectric Therapy: Mechanisms and Practical Implications. Springer, New York 2009, S. 10–11
- M. W. Deyell et al.: The implantable cardioverter-defibrillator: From Mirowski to its current use. In: BCMJ, Ausgabe 52, Nr. 5, Juni 2010. Englisch, abgerufen am 5. März 2015
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/ Heidelberg/ New York u. a. 1999, ISBN 3-540-65024-5, S. 6 f.
- K. Bauer, J. Ennker: Herzschrittmacher und Defibrillatoren. Steinkopff Verlag, Darmstadt 2005, doi:10.1007/3-7985-1534-4_3, S. 63–125.
- Gerd Fröhlig, Jörg Carlsson, Jens Jung, Walter Koglek, Bernd Lemke, Andreas Markewitz, Jörg Neuzner (Hrsg.): Herzschrittmacher- und Defibrillator-Therapie : Indikation – Programmierung – Nachsorge. 480 Abb. 2., vollständig überarbeitete und aktualisierte Auflage. Thieme, Stuttgart 2013, ISBN 978-3-13-117182-5.
- R. Weiss, B. P. Knight, M. R. Gold, A. R. Leon, J. M. Herre, M. Hood, M. Rashtian, M. Kremers, I. Crozier, K. L. Lee, W. Smith, M. C. Burke: Safety and Efficacy of a Totally Subcutaneous Implantable-Cardioverter Defibrillator. In: Circulation. 128, 2013, S. 944–953, doi:10.1161/CIRCULATIONAHA.113.003042
- A. Aydin, F. Hartel, M. Schluter, C. Butter, J. Kobe, M. Seifert, N. Gosau, B. Hoffmann, M. Hoffmann, E. Vettorazzi, I. Wilke, K. Wegscheider, H. Reichenspurner, L. Eckardt, D. Steven, S. Willems: Shock Efficacy of Subcutaneous Implantable Cardioverter-Defibrillator for Prevention of Sudden Cardiac Death: Initial Multicenter Experience. In: Circulation: Arrhythmia and Electrophysiology. 5, 2012, S. 913–919, doi:10.1161/CIRCEP.112.973339.
- New implanted defibrillator works well without touching heart sciencedaily.com, 26. August 2013.
- S. Müller: Memorix Notfallmedizin.Georg Thieme Verlag, Stuttgart 2011, S. 90
- B. Naegeli: Die Kehrseite der Medaille: Langzeitkomplikationen nach ICD-Implantation reports-news.universimed.com, 19. März 2015 (archivierte Webseite).
- Medizinische Klinik für Kardiologie der Charité Berlin: Implantation von Defibrillatoren. (Memento des Originals vom 2. April 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., abgerufen am 19. März 2015
- Wolber T. et al. Potential interference of small neodymium magnets with cardiac pacemakers and implantable cardioverter-defibrillators. In: Heart Rhythm. 2007;4(1): 1–4. Epub 2006 Sep 16. PMID 17198980
- MP3 Headphones Interfere With Implantable Defibrillators, Pacemakers, Study Suggests sciencedaily.com, 10. November 2008.
- D. M. Ginzburg et al.: Psychische Störungen nach ICD-Mehrfachschocks und deren psychotherapeutische Behandlung. (Memento des Originals vom 13. Mai 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Kardiologe 2011 doi:10.1007/s12181-011-0331-5
- M. Tavenaux , D.M. Ginzburg , A. Boukacem , J. Sperzel , C. Hamm , J. Jordan: Veränderungen bei Depression, Angst und vitaler Erschöpfung bei Patienten nach einer ICD-Implantation. Vergleich klinischer Subgruppen. In: Herzschr Elektrophys 2011 22:174–180 doi:10.1007/s00399-011-0144-z
- Radbruch, Andersohn und Walker: Überversorgung kurativ – Unterversorgung palliativ? Analyse ausgewählter Behandlungen am Lebensende. Bertelsmann-Stiftung, Gütersloh 2015, S. 29
- J. Carlsson et al.: Deaktivierung von-implantierbaren Defibrillatoren: Medizinische, ethische, praktische und juristische Aspekte. Dtsch Arztebl Int 2012; 109(33-34): 535-41; doi:10.3238/arztebl.2012.0535
- E. Albrecht: Der Sterbevorgang. In: Bausewein et al. (Hrsg.): Leitfaden Palliative Care. Palliativmedizin und Hospizbetreuung. Urban & Fischer, München 2010, S. 524
- Bericht des Deutschen Herzschrittmacher Registers 12 – Teil 2 Defibrillatoren; Anhang 1 Tabelle 7 Seite 9