Kunstherz
Ein Kunstherz (künstliches Herz, Herzunterstützungssystem, ventricular assist device VAD, Ventrikuläres Unterstützungssystem) wird in den Körper von Patienten mit unheilbaren Herzerkrankungen (z. B. Herzinsuffizienz) eingesetzt, weil das Herz des Patienten nicht mehr in der Lage ist, den Körperkreislauf ausreichend aufrechtzuerhalten. Deswegen spricht man auch vom Kreislaufunterstützungssystem.
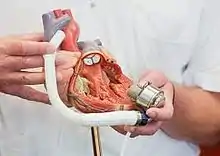
Typen
Es werden mehrere Arten von Kunstherzen unterschieden.
Unterteilung nach anatomischen Kriterien
- Linksventrikuläres Unterstützungssystem (LVAD)
- Diese Art von Kunstherz wird in die linke Herzkammer eingesetzt und pumpt das Blut von dort in die Aorta. Diese Art der Unterstützung des großen Kreislaufs stellt die häufigste Art von Kunstherzen dar.
- Rechtsventrikuläres Unterstützungssystem (RVAD)
- Ein RVAD wird in die rechte Herzkammer implantiert und pumpt das Blut in die Pulmonalarterie. Hier wird nur der Lungenkreislauf unterstützt.
- Biventrikuläres Unterstützungssystem (BiVAD)
- Die zeitgleiche LVAD- und RVAD-Unterstützung der linken und rechten Herzkammer dient bis zur Erreichung des Therapieziels der Unterstützung des gesamten Herzens, wobei das menschliche Herz erhalten bleibt.
- Total artificial heart (TAH)
- Das totale Kunstherz ersetzt das menschliche Herz vollständig. Bei der Operation wird das Herz des Patienten vollständig explantiert und durch eine mechanische Pumpe ersetzt. Hier werden der kleine und der große Kreislauf übernommen.
Unterteilung nach Funktionsart
- Pulsatile Herzunterstützungssysteme
- Bei dieser Art von Kunstherz wird der körpereigene Puls in der Regel durch die Verwendung druckluft-betriebener getakteter (pulsatiler) Blutpumpen simuliert.
- Nicht-pulsatile Herzunterstützungssysteme
- Bei dieser Art von Kunstherz wird das Blut in der Regel durch kontinuierlich fördernde Axial- oder Zentrifugalpumpen gefördert.
Operation
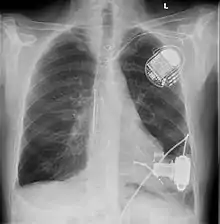
Kunstherzimplantationen sind in den letzten Jahren durch viele technische Verbesserungen im Pumpendesign und chirurgische Verbesserungen im Bereich der Implantationstechniken zu einer herzchirurgischen Standardoperation geworden. Während in der Vergangenheit die Operationen große Schnitte und viele Tage auf der Intensivstation bedeuteten, sind heute bereits minimal-invasive Implantationstechniken und kurze Intensivaufenthalte möglich.
Kunstherzen werden von Herzchirurgen eingesetzt. Die Operation wird in Narkose durchgeführt und dauert etwa drei Stunden. In den meisten Fällen wird die Operation an der Herz-Lungen-Maschine durchgeführt.
Standard-Implantationstechnik
Die traditionelle Kunstherzimplantation erfolgt über eine totale, mediane Sternotomie, d. h. über eine vollständige Durchtrennung des Brustbeines. Hiernach folgt der Anschluss des Patienten an die Herz-Lungen-Maschine und die Freipräparation des Herzens. Der Einflusstrakt des Unterstützungssystems wird über einen Haltering am Herzen befestigt und der Ausflusstrakt an die Aorta genäht. Das Batteriekabel wird über mehrere kleine Schnitte aus dem Unterbauch ausgeleitet. Anschließend wird das Kunstherz getestet, die Herz-Lungen-Maschine entwöhnt und am Ende der Operation wird das Brustbein mittels Drähten wieder verschlossen.
Minimal-invasive Implantationen

Neuere Methoden verzichten weitestgehend auf die totale Öffnung des Brustbeines. Die gängigsten minimal-invasiven Techniken verwenden einen seitlichen Schnitt an der linken Brustwand, über den das Unterstützungssystem in die linke Herzkammer eingesetzt wird. Dieser Zugang wird häufig durch eine partielle Durchtrennung des oberen Drittels des Brustbeines ergänzt. Andere Kombinationsmöglichkeiten sind Schnitte unterhalb des linken oder rechten Schlüsselbeines. Anhand der Schnittführung werden verschiedene Befestigungsstellen für den Ausflusstrakt des Kunstherzens möglich. Die Wahl, an welchem Gefäß der Ausflusstrakt befestigt wird, richtet sich nach der individuellen Anatomie und Krankheitssituation des Patienten.
Die Medizinische Hochschule Hannover hat die minimal-invasive Technik entwickelt und maßgeblich gefördert. Die Vorteile einer minimal-invasiven VAD Implantation liegen nicht nur im kosmetischen Bereich. Durch die kleineren Schnitte entsteht weniger Narbengewebe und Wundfläche. Daher reduzieren sich die Risiken für Blutungen und Infektionen. Es kann sogar ohne die Verwendung von Bluttransfusionen operiert werden.[1] Auch im Falle einer Re-Operation, z. B. einer anschließenden Herztransplantation, sind Verwachsungen verringert.
Andere Zentren wie das Deutsche Herzzentrum Berlin und die Medizinische Universitätsklinik Wien haben Methoden entwickelt, bei der das Brustbein nicht durchtrennt werden muss. Der Eingriff erfolgt dabei durch zwei kleine Einschnitte links und rechts seitlich des Brustbeins.[2][3] Hierbei handelt es sich jedoch um keinen Standardzugang der Kunstherzchirurgie, da der Ausflussgraft des Kunstherzens nicht an die Aorta, sondern an andere Gefäße wie z. B. die Arteria subclavia unter dem Schlüsselbein angeschlossen wird. Hierdurch entstehen unphysiologische Blutflüsse. Für spezielle anatomische Verhältnisse existieren eine Vielzahl von Varianten der konventionellen sowie minimal-invasiven Implantationstechnik.[4]
Die Entscheidung, ob ein Kunstherz durch eine konventionelle oder die minimal-invasive Technik implantiert wird, ist stark abhängig davon, welches Kunstherzmodell implantiert wird und ob der Patient anatomische Besonderheiten wie z. B. eine verkalkte Aorta vorweist.
Therapieziele
Es existieren verschiedene Therapieziele für Kunstherzpatienten:
- Bridge to transplant
- Das Kunstherz wird eingesetzt und der aktuelle Gesundheitszustand des Patienten stabilisiert bzw. verbessert. Sobald ein geeignetes Spenderorgan zur Verfügung steht, wird das Kunstherz wieder explantiert und ein menschliches Herz transplantiert.
- Bridge to recovery
- In wenigen Fällen kann es nach einer Kunstherzimplantation zu einer Erholung des Herzmuskels kommen, so dass das Kunstherz wieder explantiert werden kann.
- Bridge to bridge
- Bei der Überbrückung zur Überbrückung ist nicht die Herztransplantation das angestrebte Therapieziel, sondern eine möglichst lange Therapie mittels Herzunterstützungssystem. Hierbei handelt es sich um ältere Patienten, die nicht mehr für eine Herztransplantation in Frage kommen, oder um Patienten, die sich nicht dem Risiko einer Herztransplantation aussetzen wollen. Bei Komplikationen des Unterstützungssystems findet daher eine Auswechslung des geschädigten Geräts statt oder es wird eine neuere, verbesserte Pumpe implantiert.
- Destination therapy
- Hier wird das Kunstherz als Dauerlösung angesehen. Diese Strategie findet Anwendung bei Patienten, deren Gesundheitszustand eine Herztransplantation nicht zulässt. Des Weiteren entscheiden sich auch viele Kunstherzpatienten für diese Strategie, weil sie mit dem System gut zurechtkommen und die Risiken einer Herztransplantation nicht auf sich nehmen wollen.
- Eine Abwandlung dieser Strategie stellt das Bridge to bridge-Verfahren dar. Sollte es zum Kunstherzwechsel nach einigen Therapiejahren kommen, kann bei dieser Strategie ein neues Kunstherzsystem eingebaut werden, das gegenüber dem alten System technische Verbesserungen aufweist.
Leben mit einem Kunstherzen
Die Kunstherztherapie dient der Leistungssteigerung der herzinsuffizienten Patienten. Das Herzzeitvolumen soll vergrößert werden. Neben der daraus resultierenden gesteigerten Lebensqualität finden sich jedoch auch Nachteile dieser Therapie.
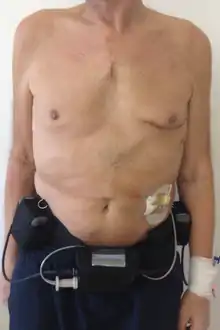
- Begrenzte Batterielaufzeit
Die Akkuleistung eines Herzunterstützungssystems beträgt je nach System und Hersteller etwa vier bis acht Stunden pro Batterie. Jederzeit sind zwei Batterien an das Gerät angeschlossen. Nach dem Ende der Akkulaufzeit müssen die Batterien gewechselt werden. - Infektionsgefahr
Durch die künstliche Austrittspforte unterhalb des Bauchnabels können Bakterien in den Körper eintreten. Dies kann zu Infektionen führen. Um diesen Nachteil zu vermeiden, wurden Methoden entwickelt, um die Energie und die Steuersignale drahtlos mit Hilfe der elektromagnetischen Induktion durch die Haut hindurch zu übertragen. - Notwendigkeit von Antikoagulation
Durch die Scherkräfte im Kunstherzen kann es zu Thrombenbildung im Blut kommen. Um das Risiko von Schlaganfällen und Embolien zu verringern, ist während der Unterstützungszeit zwingend eine Antikoagulation notwendig. Die Therapie der Wahl sind Vitamin-K-Antagonisten. Zusätzlich erfordern viele Kunstherzen eine doppelte Antikoagulation durch einen zusätzlichen Thrombozytenaggregationshemmer.
Geschichtliche Aspekte


Die erste Kunstherz-Implantation wurde am 4. April 1969 am Texas Heart Institute in Houston, USA durch Denton A. Cooley vorgenommen. Der 47-jährige Patient Haskell Karp erhielt ein von Domingo Liotta entwickeltes Kunstherz, das nach 65 Stunden durch ein natürliches Herz ersetzt wurde. Kurz nach der Herztransplantation starb Karp.
Als erstes dauerhaftes Herzimplantat gilt das Jarvik-7 von Robert Jarvik, das am 2. Dezember 1982 in der Universitätsklinik von Utah (University of Utah) in Salt Lake City Barney Clark (21. Januar 1921 bis 23. März 1983) in einer siebenstündigen Operation eingesetzt wurde. Die Operation führte William DeVries aus. Clark überlebte 112 Tage und erlitt mehrere Thrombosen, bevor er starb. Am 25. November 1984 wurde dem US-Amerikaner William J. Schroeder ein Kunstherz ebenfalls vom Typ Jarvik-7 implantiert, mit dem er 620 Tage überlebte und am 6. August 1986 an einem Schlaganfall verstarb.
In Berlin forschte der deutsche Wissenschaftler und Herzchirurg Emil Bücherl seit den 1960er Jahren an der Herstellung von Kunstherzen. In mehreren Tierversuchen konnte die Überlebensdauer gesteigert werden. So überlebte 1981 ein Kalb nach einer Kunstherzeinpflanzung 268 Tage und eine Ziege im Jahre 1984 rund 345 Tage. 1979 wurde das als Berliner Kunstherz in Deutschland bekannt gewordene Organ einem Menschen implantiert und diente kurzfristig zur Unterstützung dessen Blutkreislaufes.
Im Oktober 1990 wurde am Deutschen Herzzentrum Berlin (DHZB) bei einem Kind die Wartezeit auf ein Transplantat erstmals erfolgreich mit einem Kunstherzen überbrückt.[5]
Nach 160 Tagen Entlastung durch ein Kunstherz erholte sich das natürliche, bislang schwerkranke Herz eines 38-jährigen Thüringers so gut, dass das Kunstherz am 10. April 1994 im Deutschen Herzzentrum Berlin explantiert werden konnte und dem Patienten eine Transplantation somit erspart blieb. Dies war weltweit der erste Fall.[6][7]
Seither konnten am DHZB über 100 Kunstherzen wieder explantiert werden, weil sich der Herzmuskel der Patienten während der Unterstützung wieder erholt hatte. Die Klinik verfügt über ein spezielles Programm zur Erholung des Myokards von Kunstherzpatienten. Um die Herzmuskel bei der Explantation des VAD nicht zu sehr zu schädigen, wurde am DHZB auch ein spezielles Verschlusssystem entwickelt, das für jeden Patienten individuell angefertigt wird.[8]
Am 13. November 1998 wurde am Deutschen Herzzentrum Berlin mit dem „Micromed DeBakey VAD“ zum ersten Mal ein nichtpulsatiles axiales VAD-System eingesetzt.[9]
Heutzutage können Kunstherzpatienten mehr als fünf Jahre mittels des Herzunterstützungssystems versorgt werden. Die derzeitigen Europarekordler wurden an der Medizinischen Hochschule Hannover implantiert.
Am 18. Dezember 2013 implantierte im Pariser Georges-Pompidou-Spital ein Operationsteam unter Christian Latrémouille[10] ein Kunstherz mit biosynthetischer Haut. Diese hat den Vorteil, dass das Risiko einer Abstoßung minimiert wird. Das Kunstherz ist eine Bioprothese und kann somit das biologische Herz ersetzen. Es ist etwa zwei Fäuste groß; eine kleinere Version befindet sich in der Entwicklung. Laut Entwickler Alain Carpentier soll damit eine Transplantation eines biologischen Herzens fünf Jahre überbrückt werden, dank eingebauter Batterie und Sensoren.[11] Der Patient verstarb nach 75 Tagen.[12][13]
Die Investitionen für die Entwicklung betrugen rund 100 Millionen Euro.[11] Die Unterstützung durch den Matra-Konzern unter ihrem damaligen Generaldirektor Jean-Luc Lagardère legte den Grundstock für die Finanzierung. Weitere Mittel wurden durch staatliche Forschungskredite und von Investitionsfonds beigesteuert. Insbesondere der Fonds Oseo investierte 33 Millionen Euro.[10] Der Preis dieses künstlichen Herzens soll rund 160.000 € pro Exemplar betragen.[10]

Im Juni 2014 wurde an der Medizinischen Hochschule Hannover das weltweit erste HeartMate-III-Kunstherz durch Axel Haverich und Jan D. Schmitto implantiert.[14]
Mit bisher über 2800 Implantationen betreibt das Deutsche Herzzentrum Berlin das größte Kunstherzprogramm weltweit.[15][16]
Am 12. November 2015 erreichte der Patient Uwe S. der Medizinischen Hochschule Hannover den Meilenstein von zehn Jahren Kunstherztherapie mit dem Gerät HeartMate II. Er gilt als Inhaber des diesbezüglichen Europarekords als Kunstherzpatient.[17]
Im Frühjahr 2016 implantierten die Herzchirurgen Evgenij Potapov und Thomas Krabatsch am Deutschen Herzzentrum Berlin einem Patienten aus Thüringen ein Kunstherz vom Typ „HeartMate 3“ zum ersten Mal weltweit erfolgreich an beiden Herzhälften.[18]
Im Jahr 2017 veröffentlichten die Chirurgen der Medizinischen Hochschule Hannover die erste Serie von Kunstherz-Upgrades auf das aktuell modernste Kunstherz HeartMate 3.[19] Diese Technik ermöglicht eine erfolgreiche Therapie von Kunstherzpatienten, die z. B. aufgrund einer Drivelineinfektion oder einer Pumpenthrombose operiert werden müssen. Gleichzeitig mit dem notwendigen Kunstherzwechsel[20] wird ein Kunstherz der neusten Generation[21][22] implantiert, so dass der Patient von den Vorteilen der neuen Pumpe profitiert.
Quellen
- Patent US4173796: Total artificial hearts and cardiac assist devices powered and controlled by reversible electrohydraulic energy converters.
Weblinks
Einzelnachweise
- Jasmin S. Hanke, Murat Avsar, Axel Haverich, Jan D. Schmitto: Heart-Failing Jehovah's Witness Patient Successfully Treated by Minimally Invasive LVAD Implantation without Any Blood Transfusions. In: The Thoracic and Cardiovascular Surgeon Reports. Band 4, Nr. 1, 1. Dezember 2015, ISSN 2194-7635, S. 21–24, doi:10.1055/s-0035-1564614, PMID 28078199, PMC 5223739 (freier Volltext) – (englisch).
- E. Potapov, T. Kranatsch: Minimally invasive continuous-flow left ventricular assist device implantation: Avoiding a median sternotomy. In: The Journal of Heart and Lung Transplantation. 33, 2014, S. 1199–120.
- Thomas Haberl, Julia Riebandt, Stephane Mahr, Guenther Laufer, Angela Rajek: Viennese approach to minimize the invasiveness of ventricular assist device implantation. In: European Journal of Cardio-Thoracic Surgery. Band 46, Nr. 6, 1. Dezember 2014, ISSN 1010-7940, S. 991–996, doi:10.1093/ejcts/ezu051 (englisch, oup.com [abgerufen am 8. März 2017]).
- Jasmin S. Hanke, Sebastian V. Rojas, Andreas Martens, Jan D. Schmitto: Minimally invasive left ventricular assist device implantation with outflow graft anastomosis to the innominate artery. In: The Journal of Thoracic and Cardiovascular Surgery. Band 149, Nr. 4, 1. April 2015, ISSN 1097-685X, S. e69–70, doi:10.1016/j.jtcvs.2014.12.066, PMID 25659850 (englisch).
- Geschichte des DHZB (Memento des Originals vom 30. August 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Geschichte des DHZB (Memento des Originals vom 30. August 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- M. Dandel, C. Knosalla, R. Hetzer: Contribution of ventricular assist devices to the recovery of failing hearts: a review and the Berlin Heart Center Experience. In: European Journal of Heart Failure. 16, 2014, S. 248–263. doi:10.1002/ejhf.18.
- E. V. Potapov u. a.: A titanium plug simplifies left ventricular assist device removal after myocardial recovery. In: Journal of Heart and Lung Transplantation. 29, 2010, S. 1316–1317.
- E. Potapov u. a. Thoracic Transplantation and Ventricular Assist Devices Pulsatile Flow in Patients With a Novel Nonpulsatile Implantable Ventricular Assist Device. In: Circulation. 102, 2000, S. Iii-183–Iii-187.
- Cœur artificiel : une prouesse made in France. In: Le Monde. 24. Dezember 2013, S. 1.
- Rudolf Balmer: Neuartiges Kunstherz als Hoffnung für Zehntausende von Patienten in der Welt. In: Neue Zürcher Zeitung. 23. Dezember 2013, abgerufen am 24. Dezember 2013.
- Gesundheit: Erster Besitzer des neuen Kunstherzens gestorben. In: FAZ. Abgerufen am 8. März 2014.
- Empfänger eines Kunstherzens: Patient stirbt nach nur 75 Tagen – N24.de. Abgerufen am 8. März 2014.
- Thoratec Announces First HeartMate III™ Human Implant. (Nicht mehr online verfügbar.) Archiviert vom Original am 7. Oktober 2014; abgerufen am 7. Oktober 2014. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Größtes Kunstherzprogramm der Welt (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- https://www.dhzb.de/de/aktuell/hintergrundinformationen/daten_und_fakten/@1@2Vorlage:Toter+Link/www.dhzb.de (Seite+nicht+mehr+abrufbar,+Suche+in+Webarchiven) Datei:Pictogram+voting+info.svg Info:+Der+Link+wurde+automatisch+als+defekt+markiert.+Bitte+prüfe+den+Link+gemäß+Anleitung+und+entferne+dann+diesen+Hinweis.+
- Stefan Zorn: Die Pumpe gehört zu mir wie ein zweites Herz.
- https://www.dhzb.de/de/aktuell/news/detailansicht_meldungen/ansicht/pressedetail/doppeltes_kunstherz/@1@2Vorlage:Toter+Link/www.dhzb.de (Seite+nicht+mehr+abrufbar,+Suche+in+Webarchiven) Datei:Pictogram+voting+info.svg Info:+Der+Link+wurde+automatisch+als+defekt+markiert.+Bitte+prüfe+den+Link+gemäß+Anleitung+und+entferne+dann+diesen+Hinweis.+
- J. S. Hanke, S. V. Rojas, G. Dogan, C. Feldmann, E. Beckmann: First Series of Left Ventricular Assist Device Upgrades to HeartMate 3. In: The Thoracic and Cardiovascular Surgeon. Band 65, S 01, 1. Januar 2017, ISSN 0171-6425, S. S1–S110, doi:10.1055/s-0037-1598839 (englisch).
- Sebastian V. Rojas, Murat Avsar, Zain Khalpey, Jasmin S. Hanke, Axel Haverich: Minimally Invasive Off-Pump Left Ventricular Assist Device Exchange: Anterolateral Thoracotomy. In: Artificial Organs. Band 38, Nr. 7, 1. Juli 2014, ISSN 1525-1594, S. 539–542, doi:10.1111/aor.12226 (englisch).
- Jasmin S. Hanke, Axel Haverich, Jan D. Schmitto: Exchange of a HeartMate II left ventricular assist device with a HeartMate 3 pump. In: The Journal of Heart and Lung Transplantation: The Official Publication of the International Society for Heart Transplantation. Band 35, Nr. 7, 1. Juli 2016, ISSN 1557-3117, S. 944–946, doi:10.1016/j.healun.2016.03.013, PMID 27160494 (englisch).
- Jasmin S. Hanke, Axel Haverich, Jan D. Schmitto: Exchange of a HeartWare HVAD to a HeartMate 3 left ventricular assist device. In: The Journal of Heart and Lung Transplantation. doi:10.1016/j.healun.2016.12.005 (englisch).