Ixekizumab
Ixekizumab ist ein Arzneistoff zur Behandlung der Schuppenflechte (Psoriasis) und der Psoriasisarthritis. Der humanisierte monoklonale Antikörper wird rekombinant in CHO-Zellen hergestellt.
| Ixekizumab | ||
|---|---|---|
| Masse/Länge Primärstruktur | 146,2 kDa | |
| Bezeichner | ||
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | L04AC13 | |
| DrugBank | DB11569 | |
| Wirkstoffklasse | Monoklonaler Antikörper, Immunsuppressivum | |
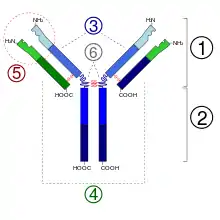
1. Fab-Abschnitt
2. Fc-Abschnitt
3. schwere Ketten
4. leichte Ketten
5. Antigenbindungsstelle (Paratop)
6. hinge-Region (dt. ‚Scharnier‘)
(*) -S-S-Disulfidbrücke
Eigenschaften
Ixekizumab ist ein humanisiertes Immunglobulin G der Subklasse 4 (IgG4). Es besteht aus zwei identischen langen („schweren“) Proteinketten aus je 445 Aminosäuren und zwei identischen kurzen („leichten“) Proteinketten aus je 219 Aminosäuren, die in Summe die molare Masse des Proteins von 146.158 Dalton ausmachen. Die schweren Ketten sind je am Asn-296 mit einem Oligosaccharid glycosiliert. Die Ketten sind über Disulfidbrücken miteinander verbunden.
Durch den Austausch von Serin in der Gelenkregion in Position 227 (S-227) durch Prolin wird die Dissoziation in zwei Halbantikörper unterdrückt. Das Fehlen des im IgG4-Wildtyp vorkommenden terminalen Lysins (K-447) trägt ebenfalls zur strukturellen Stabilität des Homodimers bei.[1]
Wirkungsmechanismus
Ixekizumab bindet selektiv und mit hoher Affinität an Interleukin-17A (IL-17A), ein pro-inflammatorisches Zytokin, welches mit Entzündungs- und Autoimmunerkrankungen wie Psoriasis in Verbindung gebracht wird. Die biologisch aktive Form von IL-17A umfasst sowohl das Homodimer IL-17A als auch das Heterodimer IL-17AF. Erhöhte IL-17A-Konzentrationen stimulieren in der Haut die Proliferation und Aktivierung von Keratinozyten. Auch induziert IL-17A die Produktion anderer Zytokine und Prostaglandine und spielt eine Rolle bei der Aktivierung CD4-positiver Zellen. Die Neutralisierung von IL-17A durch Ixekizumab hemmt diese Prozesse.
Ixekizumab neutralisiert nicht die weiteren Subtypen der Interleukin-17-Familie IL-17B bis F.[2]
Anwendungsgebiete
Ixekizumab ist in den USA seit März 2016, in der EU seit April 2016 unter dem Namen Taltz zugelassen zur systemischen Behandlung erwachsener Patienten mit mittelschwerer bis schwerer Plaque-Psoriasis. Das Arzneimittel wird subkutan verabreicht und kann vom Patienten mit einem Pen selbst gespritzt werden. Nach der Gabe einer Initialdosis wird das Medikament bis zur Woche 12 alle zwei Wochen, danach alle vier Wochen verabreicht.[2] Taltz wurde von Eli Lilly entwickelt.
Für die Indikation Psoriasisarthritis wurde Ixekizumab im Dezember 2017 von der US-amerikanischen Zulassungsbehörde (FDA) für die USA zugelassen.[3] Die EU-Zulassung für diese Indikation erfolgte im Januar 2018.[4]
Zulassungsstudien
Ixekizumab wurde in drei randomisierten doppelblinden klinischen Studien mit insgesamt 3.866 Teilnehmern mit Plaque-Psoriasis hinsichtlich Sicherheit und Wirksamkeit untersucht und erwies sich gegenüber einer Therapie mit Placebo oder Etanercept als überlegen.[2]
Als kombinierter primärer Endpunkt wurde in allen Studien ein PASI-75-Ansprechen und ein sPGA von 0 („erscheinungsfrei“) oder 1 („fast erscheinungsfrei“) nach 12 Wochen herangezogen.
Nebenwirkungen und Anwendungsbeschränkungen
Als häufigste Nebenwirkungen wurden Reaktionen an der Injektionsstelle und Infektionen der oberen Atemwege – insbesondere Nasopharyngitis (Entzündung der Nasen- und Rachen-Schleimhaut) – beobachtet. Die Behandlung mit Ixekizumab führt auch zu einer erhöhten Infektionsrate für orale Candidosen, Konjunktivitis und Tinea-Infektionen.
Nicht angewendet werden darf Ixekizumab beim Vorliegen einer aktiven Tuberkulose; Vorsicht ist geboten bei anderen klinisch relevanten Infektionen und entzündlichen Darmerkrankungen. Abgeraten wird die gleichzeitige Anwendung mit Lebendimpfstoffen oder die Anwendung in der Schwangerschaft.[2]
Pharmakokinetik
Nach Gabe einer Initialdosis und einem anfänglichen Dosierungsschema mit einer Gabe alle zwei Wochen wird nach acht Wochen ein Steady State erreicht.
Die durchschnittliche Bioverfügbarkeit liegt zwischen 54 % und 90 %. Die Plasmahalbwertszeit beträgt im Mittel 13 Tage.[2]
Präparatename(n)
Lilly: Taltz (USA, EU)
Weblinks
Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Ixekizumab
Einzelnachweise
- Öffentlicher Beurteilungsbericht zu Taltz (EPAR) der europäischen Arzneimittelagentur vom 25. Februar 2016.
- Produktinformation Taltz, Stand: 2. Mai 2016, Website der europäischen Arzneimittelagentur.
- Lilly's Taltz® (ixekizumab) Receives U.S. FDA Approval for the Treatment of Active Psoriatic Arthritis (Memento des Originals vom 5. Dezember 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., PM Lilly vom 1. Dezember 2017, abgerufen am 5. Dezember 2017.
- https://www.pharmazeutische-zeitung.de/2018-01/zulassungserweiterung-ixekizumab-auch-bei-psoriasis-arthritis/