Ivabradin
Ivabradin (Handelsname Procoralan®; Hersteller Servier) ist ein Arzneistoff mit ausschließlich herzfrequenzsenkender Wirkung. Es ist der Prototyp der Substanzklasse von If-Kanal-Hemmern oder If-Inhibitoren und führt am Herzen zu einer Verlangsamung des Pulses, ohne das Erregungsleitungssystem, die Muskelkraft des Herzens (Inotropie) oder den Blutdruck zu beeinflussen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
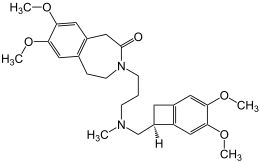 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Ivabradin | |||||||||||||||
| Andere Namen |
(S)-3-{3-[([3,4-Dimethoxybicyclo[4.2.0]octa-1,3,5-trien-7-yl]methyl)methylamino]propyl}-1,3,4,5-tetrahydro-7,8-dimethoxy-2H-3-benzazepin-2-on (IUPAC) | |||||||||||||||
| Summenformel |
| |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
C01EB17 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse |
| |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Ivabradin wird zur Behandlung der chronischen stabilen Angina pectoris bei Erwachsenen mit Sinusrhythmus eingesetzt, bei denen Betablocker kontraindiziert sind oder für die eine Unverträglichkeit vorliegt. Es wird ebenfalls in Kombination mit Betablockern bei erwachsenen Patienten angewendet, deren Zustand mit Betablockern nicht vollständig kontrolliert ist und die eine zu hohe Herzfrequenz von mehr als 60 Schlägen pro Minute haben. Im Februar 2012 erhielt Ivabradin eine Zulassungserweiterung zur Behandlung der chronischen Herzinsuffizienz (s. Anwendungsgebiete).[3]
Ivabradin hat im Oktober 2005 die europäische Zulassung erhalten. Am 2. Januar 2006 brachte es der Hersteller Servier unter dem Markennamen Procoralan in Deutschland auf den Markt.[4]
Anwendungsgebiete
Ivabradin dient zur symptomatischen Behandlung der chronischen stabilen Angina Pectoris bei Erwachsenen mit koronarer Herzkrankheit und normalem Sinusrhythmus. Ivabradin ist indiziert:
- bei Erwachsenen mit einer Unverträglichkeit für Betablocker oder falls Betablocker kontraindiziert sind; oder
- in Kombination mit Betablockern bei Patienten, die mit einer optimalen Betablockerdosis unzureichend eingestellt sind.
Ivabradin kann bei chronischer Herzinsuffizienz der NYHA Klasse II bis IV mit systolischer Dysfunktion bei Patienten im Sinusrhythmus mit einer Herzfrequenz ≥ 75 Schläge pro Minute (bpm) in Kombination mit Standardtherapie einschließlich Betablocker, oder wenn Betablocker kontraindiziert sind oder eine Unverträglichkeit vorliegt, als Therapieoption erwogen werden. Patienten mit chronischem Vorhofflimmern sind hiervon ausgenommen.[3]
Wirkungsweise
Ivabradin hemmt selektiv und spezifisch den If-Ionenstrom, der als intrinsischer Schrittmacher im Herzen die spontane diastolische Depolarisation im Sinusknoten kontrolliert und so die Herzfrequenz reguliert. Die kardialen Wirkungen sind spezifisch für den Sinusknoten und haben weder Einfluss auf intraatriale, atrioventrikuläre (PQ-Zeit) oder intraventrikuläre Leitungszeiten noch auf die myokardiale Kontraktilität (Herzmuskelkraft) oder ventrikuläre Repolarisation (QTc-Zeit). Auch die Hämodynamik und damit der Blutdruck bleiben konstant. Ivabradin wirkt hauptsächlich über die Reduktion der Herzfrequenz um wenige Schläge in der Minute. Dies reduziert den Sauerstoffbedarf des Herzens, vor allem in Situationen, in denen das Auftreten von Angina-pectoris-Anfällen wahrscheinlich ist. Auf diese Weise hilft Ivabradin, das Auftreten von Angina Pectoris zu kontrollieren und zu reduzieren.[3]
Darreichungsformen
Ivabradin steht in Filmtablettenform zur oralen Einnahme in den Wirkstärken 5 mg und 7,5 mg zur Verfügung.[4]
Nebenwirkungen
Als häufigste unerwünschte Arzneimittelwirkung traten bei 2 bis 14,5 Prozent der Patienten dosisabhängig und rückbildungsfähig Phosphene (Lichtwahrnehmungen im Sinne isolierter Aufhellungen im Gesichtsfeld) auf, die während (bei 77,5 Prozent der Patienten) oder nach der Behandlung wieder verschwanden. Verursacht werden sie durch kompetitive Hemmung einer Variation des If-Kanals in der Retina. Bei Patienten mit Retinitis pigmentosa ist Vorsicht angebracht.[4][5]
Kontraindikationen
Ivabradin soll nicht eingesetzt werden bei[4]
- Überempfindlichkeit gegen Ivabradin,
- einer Ruhe-Herzfrequenz unter 60/min vor der Behandlung, Sick-Sinus-Syndrom, SA-Block oder AV-Block dritten Grades,
- Herzschrittmacher-Abhängigkeit,
- akutem Myokardinfarkt, instabiler Angina Pectoris,
- Patienten mit Hypotonie unter 90/50 mmHg, instabiler oder akuter Herzinsuffizienz sowie kardiogenem Schock,
- schwerer Leberinsuffizienz,
- Anwendung von starken Cytochrom-P450-3A4-Hemmern wie Antimykotika vom Azoltyp (Ketoconazol, Itraconazol), Makrolidantibiotika (Clarithromycin, Erythromycin p. o., Josamycin, Telithromycin), HIV-Proteaseinhibitoren (Nelfinavir, Ritonavir) und Nefazodon,
- Schwangerschaft und Stillzeit.
Pharmakokinetik
Ivabradin wird nach oraler Einnahme schnell und fast vollständig resorbiert. Maximale Plasmaspiegel werden nüchtern nach etwa einer Stunde erreicht. Die Bioverfügbarkeit liegt bei etwa 40 Prozent (first-pass-effect). Durch Nahrung wird die Resorption um etwa eine Stunde verzögert. Ivabradin wird zu etwa 70 Prozent an Plasmaprotein gebunden.[4]
Ivabradin wird weitgehend in der Leber und im Darm über das Cytochrom P450 3A4 (CYP3A4) metabolisiert (verstoffwechselt) und mit einer effektiven Halbwertszeit von elf Stunden abgebaut. Es ist ein schwacher Hemmstoff vom CYP3A4.
Handelsnamen
Corlentor (A), Procoralan (D, A, CH). Die Handelspräparate enthalten das Hydrochlorid von Ivabradin.[3][6] Seit April 2018 ist der Wirkstoff Ivabradin auch als Generikum in Deutschland erhältlich, z. B. unter dem Markennamen Ivabalan (Firma TAD Pharma), Ivabradin Hennig (Firma Hennig), Ivabradin Glenmark (Firma Glenmark) und einigen weiteren Firmen.[7]
Weblinks
- Landesärztekammer Hessen: Informationsbrief des Herstellers zu potenziell gefährlichen Bradykardien im Zusammenhang mit der Anwendung von Procoralan® (Ivabradin). 11. Juni 2014, abgerufen am 12. Juni 2014.
Einzelnachweise
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 907, ISBN 978-0-911910-00-1.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Fachinformation Procoralan®: (PDF; 111 kB) auf Fachinfo-Service.
- Zusammenfassung der Merkmale des Arzneimittels, Stand: Juli 2010 (PDF; 130 kB) auf der Website der Europäischen Arzneimittelagentur.
- Summary of the European public assessment report (EPAR) for Procoralan Wissenschaftliche Diskussion des Zulassungsberichtes der Europäischen Arzneimittelagentur (engl.).
- ROTE LISTE 2008, Verlag Rote Liste Service GmbH, Frankfurt am Main, ISBN 978-3-939192-20-6.
- Apotheke Adhoc: Procoralan - Weg frei für Generika. Abgerufen am 10. April 2018.