Nelfinavir
Nelfinavir (NLV, Handelsname: Viracept, Hersteller: Hoffmann-La Roche) ist ein Arzneistoff aus der Gruppe der HIV-Proteaseinhibitoren und angezeigt zur antiretroviralen Behandlung bei HIV-1-infizierten Patienten. HIV-Proteaseinhibitoren werden im Zuge einer sogenannten „highly active antiretroviral therapy“ (HAART) mit anderen antiviralen Wirkstoffen (NRTI, NNRTI) kombiniert.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
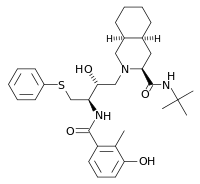 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Nelfinavir | |||||||||||||||
| Summenformel | C32H45N3O4S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
J05AE04 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 567,78 g·mol−1 | |||||||||||||||
| pKS-Wert |
6,0; 11,6[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Mit dem Ablauf der europäischen Zulassung im Januar 2013[3] stellte Roche die Produktion von Viracept aufgrund sinkender Nachfrage weltweit ein.[4]
Geschichte
Nelfinavir wurde von Agouron Pharmaceuticals (heute: Pfizer) entwickelt und 1995 patentiert.[1] Erste Nelfinavir-Formulierungen wurden von der amerikanischen FDA im März 1997 und von der europäischen Behörde im Januar 1998 zugelassen.
Indikation
Nelfinavir ist zur antiviralen Kombinationstherapie bei HIV-Infektionen angezeigt. Hierfür wird die Kombination mit zwei Wirkstoffen aus der Gruppe der Nukleosid-Analoga empfohlen.[1] Es darf bei Erwachsenen, Jugendlichen und Kindern über drei Jahren angewandt werden.
Pharmakologie
Der Wirkmechanismus ist ähnlich dem anderer HIV-Proteaseinhibitoren, es wird also ein für die Virusreplikation nötiges Enzym, die HIV-Protease, gehemmt. Allerdings ist der Bindungsmechanismus zwischen Enzym und Wirkstoff einzigartig, sodass es zu keinen Kreuzresistenzen mit anderen HIV-Proteaseinhibitoren kommt. Im Gegensatz zu solchen vermag Nelfinavir HIV-1- und HIV-2-Proteasen gleichermaßen zu hemmen. Wie bereits im Laborexperiment erkannt, trat auch in der Therapie eine gewisse Resistenzentwicklung der Viren gegen den Wirkstoff auf. Entsprechend der Praxis bei anderen HIV-Proteaseinhibitoren lässt sich diese Empfindlichkeitsminderung jedoch durch den Einsatz des Medikamentes in Kombination mit anderen antiviralen Wirkstoffen deutlich reduzieren. Ein Vorteil gegenüber früheren Vertretern derselben Gruppe ist die Tatsache, dass die Resorption von Nelfinavir durch gleichzeitige Nahrungsaufnahme deutlich verbessert wird. Die Substanz wird im Blut beinahe zur Gänze an Plasmaproteine gebunden und in der Leber verstoffwechselt. Hierbei spielt das Cytochrom P450 System die tragende Rolle, was zu mehreren Interaktionen mit anderen Arzneistoffen führt. Die Ausscheidung der Metaboliten erfolgt über den Stuhl. Die Plasmahalbwertszeit von Nelfinavir beträgt etwa 3,5 bis 5 Stunden.
Nebenwirkungen und Kontraindikationen
Die häufigsten Nebenwirkungen betreffen, wie bei ähnlichen Wirkstoffen, den Gastrointestinaltrakt (Flatulenz, Diarrhöe), wobei man feststellen konnte, dass bei Dreifachmedikation diese Beschwerden häufiger auftraten als bei einer Behandlung mit Stavudin oder Zidovudin/Lamivudin. Des Weiteren beobachtet man Kopfschmerz und Hautreaktionen, selten Müdigkeit und Hepatitis. Nelfinavir hemmt die hepatischen Monooxygenasen (Cytochrom P450) und kann über diesen Mechanismus zu mehreren Komplikationen mit anderen Arzneimitteln (z. B. Astemizol, Cisaprid, diversen Benzodiazepinen, Ergotoxinen und einigen Antiarrhythmika) führen.
Pharmazeutische Informationen
Pharmazeutisch verwendet wird Nelfinavir als Salz der Methansulfonsäure (INN: Nelfinavirmesilat).[1] Bei Arzneistoffsynthesen, in denen eine Umsetzung mit einer Sulfonsäure stattfindet, können unter ungünstigen Herstellungsbedingungen mutagen und kanzerogen wirkende Verunreinigungen entstehen. 2007 nahm Roche vorübergehend in den europäischen Ländern und einigen anderen Regionen alle Formulierungen vom Markt, nachdem in bestimmten Nelfinavir-Chargen eine solche Verunreinigung, das Ethylmethansulfonat (EMS), aufgetreten war.[5][6][7] Durch Einführung entsprechender Maßnahmen im Herstellprozess kann die Verunreinigung unterhalb eines kritischen Grenzwertes gehalten werden.
Weblinks
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Nelfinavir
- MedlinePlus-Information über Nelfinavir (englisch)
Einzelnachweise
- Eintrag zu Nelfinavir. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. Juli 2019.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Non-renewal of the marketing authorisation in the European Union (PDF; 49 kB), 24. Januar 2013.
- Pharmazeutische Zeitung 4/2013, S. 101.
- Questions and Answers on the Recall of Viracept. (PDF; 39 kB) EMA, 6. Juni 2007, abgerufen am 1. November 2017 (englisch).
- European Medicines Agency recommends lifting of suspension for Viracept. (PDF; 29 kB) EMA, 20. September 2007, abgerufen am 1. November 2017 (englisch).
- Wiedereinführung des HIV Medikaments Viracept Filmtabletten 250 mg von Roche in der Schweiz (Memento vom 4. März 2016 im Internet Archive).