Inotuzumab-Ozogamicin
Inotuzumab-Ozogamicin ist ein Antikörper-Wirkstoff-Konjugat und wird als Arzneistoff in der Therapie der akuten lymphatischen Leukämie bei bestimmten Patienten eingesetzt.
| Inotuzumab-Ozogamicin | ||
|---|---|---|
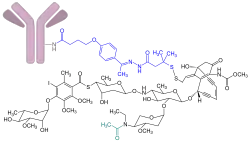
| ||
| Durchschnittlich 6 Moleküle des N-acetylierten (türkis) Bakterientoxins γ-Calicheamicin (schwarz) sind über einen spaltbaren Linker (blau) an den monoklonalen anti-CD22-Antikörper Inotuzumab (rosa) gebunden. | ||
| Masse/Länge Primärstruktur | 95347,07 Da | |
| Bezeichner | ||
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | L01XC26 | |
| DrugBank | DB05889 | |
| Wirkstoffklasse | Monoklonale Antikörper, Zytostatika, andere antineoplastische Mittel und Protektiva | |
Chemie und Eigenschaften
Inotuzumab-Ozogamicin ist ein Konjugat, bestehend aus einem monoklonalen Antikörper (Inotuzumab) und einem zytotoxischen Wirkstoff, welche über einen Hydrazon-Linker kovalent verbunden sind. Inotuzumab ist ein rekombinanter und humanisierter IgG 4κ-Antikörper. Die zytotoxische Komponente wird dargestellt von N-Acetyl-Gamma-Calicheamicin-Dimethylhydrazid, einem Calicheamicinderivat[1] und im Folgenden als Calicheamicin bezeichnet. Ein vergleichbarer Wirkstoff ist Gemtuzumab Ozogamicin.[2]
Pharmakologie
Hintergrund
Bei akuter lymphatischer Leukämie (ALL) sind Vorläuferzellen von Lymphozyten maligne entartet, wodurch es zu Störungen der Blutbildung mit komplexen Symptomen kommt. Unbehandelt kann die Erkrankung rasch letal verlaufen. Das Gesamtüberleben (Erwachsene) bei rezidivierter oder refraktärer (durch Therapie nicht beeinflussbar) ALL wird mit durchschnittlich drei bis sechs Monaten angegeben. Der bisherige Standard für in dieser Weise betroffene Patienten ist eine erneute Polychemotherapie, auf welche weniger als die Hälfte der Patienten mit Remission anspricht.[2] Weitere Informationen sind dem Hauptartikel Akute lymphatische Leukämie zu entnehmen.
Wirkmechanismus
Inotuzumab-Ozogamicin bindet über den Antikörperanteil spezifisch an den Rezeptor CD22 auf der Oberfläche von B-Lymphozyten. Daraufhin erfolgt die Aufnahme in das Zellinnere. Über den Antikörper und CD22-Signalweg wird keine zytotoxische Wirkung vermittelt. Intrazellulär wird Calicheamicin durch Hydrolyse[3] im sauren Milieu der Lysozyme[4] vom Linker abgespalten und kann nun seine Wirkung entfalten. Die aktivierte Substanz bewirkt Doppelstrangbrüche der DNA und initiiert so die Apoptose, also den Tod der Zelle.[2] Therapieziel sind normalisierte Blutwerte und komplette Remission der Krankheit.[1] Im Rahmen der Zulassungs- und Phase-III-Studie INO-VATE ALL (326 Patienten) erreichten 80,7 Prozent der Probanden eine komplette Remission (29,4 Prozent unter Chemotherapie). Inotuzumab-Ozogamicin wird vorläufig als Sprunginnovation bewertet (Pharm. Ztg.)[2]
Pharmakokinetik
Während der Therapie mit Inotuzumab-Ozogamicin stellt sich nach vier Behandlungszyklen ein Steady-State-Zustand ein. Der Wirkstoff weist einen mittleren maximalen Serumspiegel von 308 ng/ ml auf. Das Verteilungsvolumen von Inotuzumab-Ozogamicin beträgt circa 12 Liter. Calicheamicin weist in vitro eine hohe Plasmaproteinbindung (97 %) auf und ist ein Substrat von P-Glykoprotein, einem Transporterprotein. Der Serumspiegel von nicht konjugiertem Calicheamicin liegt zumeist unterhalb der Quantifizierungsgrenze von 50 pg/ ml, gelegentlich traten jedoch messbare Werte bis 276 pg/ ml auf.[3]
Der Metabolismus von Calicheamicin erfolgt in erster Linie nicht-enzymatisch durch Reduktion. Für Inotuzumab-Ozogamicin wurden im Steady-State eine Clearance von 0,0333 l/ h und eine Plasmahalbwertszeit (Ende des vierten Therapiezyklus) von 12,3 Tagen ermittelt.[3]
Da eine Freisetzung des zytotoxischen Wirkstoffs weitestgehend erst in der Zielzelle erfolgt, ist eine minimale Dosierung möglich und systemische Effekte werden reduziert. Weil Callicheamicine äußerst toxisch sind, ist die Anwendung allein durch die Kopplung an einen Antikörper möglich.[2]
Anwendung
Inotutumab-Ozogamicin wird angewandt bei Erwachsenen mit akuter lymphatischer Leukämie (rezidiv oder refraktär) mit CD22-positiven B-Vorläuferzellen. Liegt ein Philadelphiachromosom vor, ist Inotuzumab-Ozogamicin erst nach Versagen einer Therapie mit Tyrosinkinase-Inhibitoren indiziert.[2] Die Anwendung erfolgt als intravenöse Infusion in bis zu sechs Zyklen (21 bzw. 28 Tage). Häufig erfolgt eine Prämedikation mit Corticosteroiden, Antipyretika und Antihistaminika als prophylaktische Gegenmaßnahme gegenüber Nebenwirkungen und Immunreaktionen.[2]
Unerwünschte Wirkungen
Häufige Nebenwirkungen von Inotuzumab-Ozogamicin sind Blutbildveränderungen (Thrombozytopenie, Neutropenie, Leukopenie), Infektionen, Hämorrhagien, Abdominalschmerzen, Hyperthermie und Fatigue. Eine wichtige und schwerwiegende Nebenwirkungen ist die venöse okklusive Leberkrankheit, welche in Folge einer Zerstörung von Lebersinusoiden zu Venenverschluss, Blutaufstauung und Schädigung der Leber führen kann. Im Falle dieser Nebenwirkung ist die Therapie abzubrechen. Schwerwiegende Vorerkrankungen der Leber stellen eine Kontraindikation für die Anwendung des Wirkstoffs dar.[2] Da die Möglichkeit eines Tumorlyse-Syndroms besteht, sollten Patienten mit besonders hoher Tumorlast vorbeugend Arzneimittel zur Senkung des Harnsäurespiegels verabreicht werden.[3]
Inotuzumab-Ozogamicin kann die Herzphysiologie beeinflussen und so zu einer Verlängerung des QT-Intervalls führen. Somit besteht ein Interaktionspotential mit anderen Arzneimitteln, die das QT-Intervall beeinflussen. Regelmäßige Kontrollen von EKG und Elektrolyten sind empfehlenswert.[2]
Inotuzumab-Ozogamicin erweist sich im Tierversuch (Ratte) als genotoxisch, klastogen und reproduktionstoxisch.[3] Sexuelle Verhütungsmaßnahmen während der Therapie sowie für acht (Frauen) bzw. fünf (Männer) Monate nach der letzten Applikation sind erforderlich.[2]
Fertigarzneimittel
Inotuzumab-Ozogamicin wurde von Pfizer und UCB entwickelt[1] und im Jahr 2017 von Pfizer unter dem Handelsnamen Besponsa auf dem deutschen Markt eingeführt.[2] Das Arzneimittel enthält Pulver (entsprechend 1 mg Inotuzumab-Ozogamicin) für ein Konzentrat zur Herstellung einer Infusionslösung. Die Kosten für eine Durchstechflasche betragen 12.314,32 EUR (Dtl., Stand: 2019).[5] Die Zulassung erfolgte sowohl in der Europäischen Union als auch in den USA im Jahr 2017.[1]
Einzelnachweise
- Eintrag zu Inotuzumab ozogamicin in der DrugBank der University of Alberta, abgerufen am 8. August 2019.
- Pharm. Ztg. online, Arzneistoffprofil: Inotuzumab-Ozogamicin (aufgerufen am 8. August 2019)
- Pfizer Pharma, Arzneimittelfachinformation zu Besponsa®, Stand: August 2019. (Link, aufgerufen am 13. Juni 2020; eingeschränkter Zugang)
- ADC Review: Inotuzumab ozogamicin (CMC-544) Drug Description (aufgerufen am 11. August 2019)
- Besponsa® in Rote Liste online (Link, aufgerufen am 8. August 2019; eingeschränkter Zugang)