Indium(I)-bromid
Indium(I)-bromid ist eine anorganische chemische Verbindung des Indiums aus der Gruppe der Bromide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
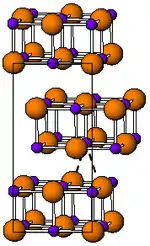 | ||||||||||||||||
| _ In+ _ Br− | ||||||||||||||||
| Kristallsystem |
orthorhombisch | |||||||||||||||
| Raumgruppe |
Cmcm (Nr. 63) | |||||||||||||||
| Gitterparameter |
| |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Indium(I)-bromid | |||||||||||||||
| Andere Namen |
Indiummonobromid | |||||||||||||||
| Verhältnisformel | InBr | |||||||||||||||
| Kurzbeschreibung |
rotbrauner geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 194,73 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,96 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
662 °C[1] | |||||||||||||||
| Löslichkeit |
reagiert mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−175 kJ·mol−1 [2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Indium(I)-bromid kann durch Reaktion von Indium mit Brom oder Indium(III)-bromid im Vakuum bei 300 bis 400 °C oder mit Quecksilber(II)-bromid bei 350 °C gewonnen werden.[3]
Eigenschaften
Indium(I)-bromid ist ein rotbrauner, stark reizender, geruchloser diamagnetischer[3] Feststoff, der mit Wasser reagiert.[1] Die Schmelze ist rot bis schwarz. Die Verbindung besitzt eine orthorhombische Kristallstruktur in der Raumgruppe Cmcm (Raumgruppen-Nr. 63) mit den Gitterparametern a = 446 pm, b = 1239 pm, c = 473 pm.[3] Der Strukturtyp ist die Thallium(I)-iodid-Struktur.[4]
Verwendung
Indium(I)-bromid wird unter anderem als Katalysator in der organischen Chemie[5] und in Schwefellampen[6] verwendet.
Einzelnachweise
- Datenblatt Indium(I) bromide, Puratronic®, 99.999% (metals basis) bei AlfaAesar, abgerufen am 18. März 2014 (PDF) (JavaScript erforderlich).
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 1393 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 870.
- Thomas Staffel, Gerd Meyer: The mono-, sesqui-, and dibromides of indium: InBr, In2Br3, and InBr2. In: Zeitschrift für anorganische und allgemeine Chemie. 552, 1987, S. 113–122, doi:10.1002/zaac.19875520913.
- Clovis Peppe, Rafael Pavodas Chagas: Indium(I) Bromide-Mediated Reductive Coupling of α,α-Dichloroketones to 1-Aryl-butane-1,4-diones. In: Synlett. 2004, S. 1187–1190, doi:10.1055/s-2004-825591.
- A. Zissis: Light Sources 2004 Proceedings of the 10th International Symposium on the ... CRC Press, 2004, ISBN 0-7503-1007-3, S. 88 (eingeschränkte Vorschau in der Google-Buchsuche).
