Thallium(I)-iodid
Thallium(I)-iodid ist eine chemische Verbindung aus der Gruppe der Thalliumverbindungen und Iodide.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
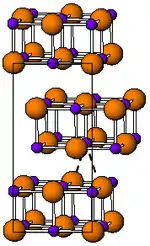 | ||||||||||||||||
| _ Tl+ _ I− | ||||||||||||||||
| Kristallsystem |
orthorhombisch | |||||||||||||||
| Raumgruppe |
Cmcm (Nr. 63) | |||||||||||||||
| Gitterparameter |
a = 458,2 pm, b = 1292 pm, c = 525,1 pm | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thallium(I)-iodid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | TlI | |||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 331,29 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
7,29 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt |
440 °C[1] | |||||||||||||||
| Siedepunkt |
824 °C[1] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Thallium(I)-iodid lässt sich durch Reaktion von Thallium(I)-sulfat oder Thallium(I)-nitrat mit Kaliumiodid gewinnen.[1]
Eigenschaften
Thallium(I)-iodid kommt in zwei enantiotropen Modifikationen vor. Unter 168 °C hat es eine orthorhombische Kristallstruktur mit der Raumgruppe Cmcm (Raumgruppen-Nr. 63) (a = 458,2, b = 1292, c = 525,1 pm). Es verfärbt sich an Licht. Bei Temperaturen über 168 °C ist liegt es als roter Feststoff mit einer Kristallstruktur vom Caesiumchlorid-Typ vor. Diese Struktur bleibt auch nach Abkühlen auf Zimmertemperatur einige Zeit unverändert bestehen.[1]
Verwendung
Thallium(I)-iodid wird als Mischkristall zusammen mit Thallium(I)-bromid als Thalliumbromidiodid bei der abgeschwächte Totalreflexion Spektroskopie eingesetzt.[5]
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 876.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag thallium compounds, with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Datenblatt Thallium(I) iodide bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 1393 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- J Michael Hollas: Moderne Methoden in der Spektroskopie; ISBN 978-3-540-67008-7, S. 59.


