Chinolizidin
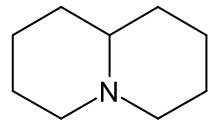
Chinolizidin ist eine chemische Verbindung aus der Gruppe der stickstoffhaltigen Heterocyclen. Es ist ein tertiäres Amin, das schwach basische Eigenschaften besitzt und zur Salzbildung befähigt ist.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Chinolizidin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C9H17N | ||||||||||||
| Kurzbeschreibung |
farbloses Öl[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 139,24 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Siedepunkt |
91 °C (53 hPa)[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Synthese
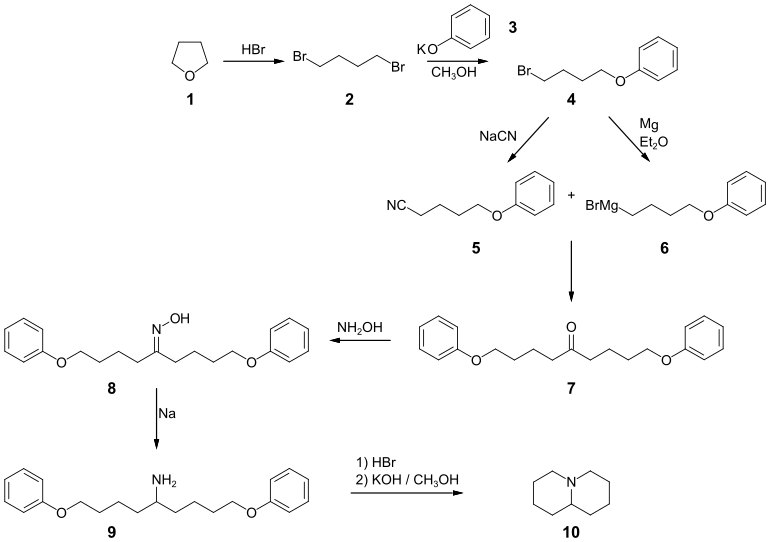
Chinolizidin kann über eine mehrstufige Synthese ausgehend von Tetrahydrofuran dargestellt werden. Im ersten Schritt wird Tetrahydrofuran 1 mit Bromwasserstoffsäure zu 1,4-Dibrombutan 2 umgesetzt. Die Reaktion des Dibromids mit einer Lösung von Kaliumphenolat 3 in Methanol ergibt 4-Phenoxybutylbromid[3] 4, das im Folgeschritt mit Natriumcyanid in Methanol zu dem 5-Phenoxypentannitril 5 reagiert. In einem separaten Schritt wird 4 mit Magnesium in Diethylether zur Grignard-Verbindung 6 umgesetzt. Die Reaktion der Zwischenstufen 5 und 6 ergeben nach der Aufarbeitung das Bis(4-phenoxybutyl)keton 7. Dieses wird mit Hydroxylamin zu dem Oxim 8 umgesetzt, das wiederum mit Natrium in Ethanol zum [Bis(4-Phenoxybutyl)methyl]amin 9 reduziert wird. Das Amin wird als Hydrochlorid isoliert. Durch Umsetzung des Hydrochlorids mit Bromwasserstoffsäure erfolgt die Etherspaltung zum Dibromid, welches ohne Zwischenisolierung mit Kaliumhydroxid in Methanol den Ringschluss zum Chinolizidin 10 eingeht.[1]
Vorkommen
.JPG.webp)
Einige bekannte Alkaloide, wie Cytisin, Lupinin oder Spartein, die in Hülsenfrüchtlern wie Lupinen vorkommen, enthalten eine Chinolizidin-Grundstruktur.[4] Ein anderer Vertreter mit pharmazeutischer Nutzung wäre das Ajmalin.
Die Chinolizidin-Alkaloide können stereoselektiv aus α-Acyliminium-Ionen in einer Art Olefin-Carbocyclisierung aufgebaut werden.[5]
Einzelnachweise
- Günther Walther: Zur Synthese des Chinolizidins (Norlupinans). In: Chemische Berichte. Band 84, Nr. 3, 1951, S. 304–307, doi:10.1002/cber.19510840309.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Externe Identifikatoren von bzw. Datenbank-Links zu 4-Phenoxybutylbromid: CAS-Nummer: 1200-03-9, EG-Nummer: 214-849-1, ECHA-InfoCard: 100.013.499, PubChem: 70986, ChemSpider: 64147, Wikidata: Q72500990.
- Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Organische Chemie: Chemie-Basiswissen II, S. 466ff, ISBN 978-3-540-77106-7.
- Gerhard Habermehl, Peter E. Hammann, Hans C. Krebs, Waldemar Ternes: Naturstoffchemie. Eine Einführung. 3. Auflage. Springer-Verlag, Berlin, Heidelberg 2008, ISBN 978-3-540-73732-2, S. 221, doi:10.1007/978-3-540-73733-9 (eingeschränkte Vorschau in der Google-Buchsuche).