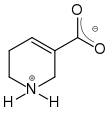
Guvacin
Guvacin ist der Trivialname für eine natürliche Carbonsäure, die ein Stickstoffatom in einem hydrierten Pyridinring enthält. Daraus folgt, dass das Molekül – wie die Aminosäuren – bevorzugt in Form eines Zwitterions vorliegt. Formal ist Guvacin der einfachste Vertreter der Areca-Alkaloide; aber als Carbonsäure kann die Verbindung kein Alkaloid in strengem Sinne sein.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Guvacin | |||||||||||||||
| Andere Namen |
1,2,5,6-Tetrahydropyridin-3-carbonsäure | |||||||||||||||
| Summenformel | C6H9NO2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 127,14 g/mol | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt |
295 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Entdeckung
In den Steinfrüchten (Nüssen) der Betelnusspalme wurde von dem Apotheker Ernst Friedrich Jahns neben den Alkaloiden Arecolin und Arecaidin ein weiterer Inhaltsstoff isoliert, der als Guvacin bezeichnet wurde. Diese chemische Verbindung weist dasselbe Molekülgerüst wie Arecaidin auf, jedoch fehlt die Methylgruppe am Stickstoffatom.
Konstitutionsaufklärung
Die Konstitution der Verbindung wurde von Karl Freudenberg (Universität Kiel), K. Hess und F. Leibbrand (Universität Freiburg, TH Karlsruhe) durch chemische Reaktionen bewiesen.[3][4]
Synthese
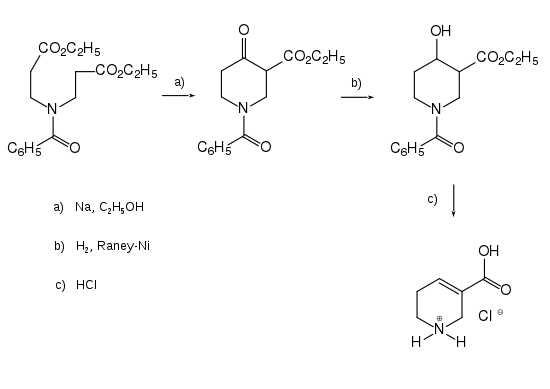
Glen M. Kuettel und Samuel Marion McElvain (University of Wisconsin) versuchten durch Dieckmann-Kondensation von 4- Azaheptandisäurediethylester – synthetisiert aus Ammoniak und Acrylsäureethylester – den Ethylester des Guvacins herzustellen. Die Ausbeute war jedoch unbefriedigend.[5] Mit der Benzoylguppe als Schutzgruppe am N-Atom wurde eine Ausbeute von 66 % des N-Benzoyl-ethoxycarbonyl-piperidons (zweite Formel von links) erhalten. Reduktion der Oxo-Gruppe führte zum Piperidinol, welches durch Erhitzen mit gasförmigem Chlorwasserstoff unter Eliminierung von Wasser das Hydrochlorid der de-benzoylierten Carbonsäure, d. h. Guvacin-hydrochlorid, lieferte.[6]
Diese Synthese wurde von Wissenschaftlern der Universität Kopenhagen modifiziert, indem an Stelle der Benzoyl-Schutzgruppe die Benzyl-Schutzgruppe verwendet wurde. Diese wurde durch Hydrogenolyse entfernt und gegen die Methoxycarbonyl-Gruppe ausgetauscht. In dieser Arbeit wurden auch wichtige spektroskopische Daten publiziert.[7]
Chemische Eigenschaften
Der relativ hohe Schmelzpunkt von Guvacin spricht dafür, dass im festen Zustand die Moleküle als Zwitterionen vorliegen:
Mit Chlorwasserstoff (Salzsäure) bildet Guvacin ein Hydrochlorid.
Die Carbonsäure lässt sich verestern; der Methylester kommt als Guvacolin[8] ebenfalls in Pflanzen vor.[9]
Pharmakologie
In Versuchen an Geweben von Labortieren und in vitro wurde festgestellt, dass Guvacin die Aufnahme (englisch: uptake) von gamma-Aminobuttersäure (GABA) als kompetitiver Inhibitor hemmt.[10] Weil die Steuerung der GABA-Aufnahme zur Behandlung von neurologischer Krankheiten, z. B. Altersdemenzen, wichtig sein könnte, wurde Guvacin als Leitstruktur identifiziert und chemisch abgewandelt.[11][12]
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 11. Auflage. Rahway, N.J. 1989, ISBN 0-911910-28-X, S. 722 (englisch).
- Datenblatt Guvacine hydrochloride, ≥97% (NMR), solid bei Sigma-Aldrich, abgerufen am 26. November 2020 (PDF).
- Karl Freudenberg: Über das Guvacin. In: Berichte der deutschen Chemischen Gesellschaft 1918, Bd. 51, S. 976, doi:10.1002/cber.191805101118.
Karl Freudenberg: Über die Alkaloide der Betelnuß. In: Berichte der deutschen chemischen Gesellschaft. 51, 1918, S. 1668, doi:10.1002/cber.19180510253. - K. Hess, F. Leibbrandt: Synthese von N‐Methyl‐tetrahydropyridin‐carbonsäuren. I.: Eine neue Bildungsweise des Arecaidins und des Arecolins. Zur Aufklärung der Konstitutionen des Guvacins und des Arecains. In: Berichte der deutschen Chemischen Gesellschaft 1918, Bd. 51, 806. doi:10.1002/cber.19180510198.
K. Hess, F. Leibbrandt: Über das Guvacin, In: Berichte der deutschen Chemischen Gesellschaft 1919, Bd. 52, S. 206. doi:10.1002/cber.19190520204. - G. M. Kuettel, S. M. McElvain: Piperidine Derivatives. XI. 3-Carbethoxy-4-piperidone and 4-Piperidone Hydrochloride, In: Journal of the American Chemical Society, 1931, Bd. 53, S. 2692–2696. doi:10.1021/ja01358a035.
- S. M. McElvain, Gilbert Stork: The Preparation of 1-Benzoyl-3-carbethoxy-4-piperidone. A Synthesis of Guvacine, In: Journal of the American Chemical Society, 1946, Bd. 68, S. 1049–1053. doi:10.1021/ja01210a040.
- Povl Krogsgaard-Larsen, Karen Thyssen, Kjeld Schaumburg: Inhibitors of GABA Uptake. Syntheses and 1H NMR Spectroscopic Investigations of Guvacine,(3RS,4SR)-4-Hydroxypiperidine-3-carboxylic Acid, and Related Compounds. In: Acta Chemica Scandinavica B, Jg. 1978, Bd. 32, S. 327–334. http://actachemscand.org/pdf/acta_vol_32b_p0327-0334.pdf
- Externe Identifikatoren von bzw. Datenbank-Links zu Guvacolin: CAS-Nummer: 495-19-2, PubChem: 160492, ChemSpider: 141033, Wikidata: Q27149807.
- Kurt Heß: Über den Guvacin-methylester (Guvacolin) und sein natürliches Vorkommen, In: Berichte der deutschen chemischen Gesellschaft 1918, S. 1122. doi:10.1002/cber.191805101122.
- G. A. R. Johnston, P. Krogsgaard-Larsen, A. Stephanson: Betel nut constituents as inhibitors of gamma-aminobutyric acid uptake, In: Nature Jg. 1975, Bd. 258, S. 627–628.
- D. Lodge, G. A. R. Johnston, D. R. Curtis, S. J. Brand: Effects of the Areca nut constituents arecaidine and guvacine on the action of GABA in the cat central nervous system. In: Brain Research, Jg. 1977, https://www.academia.edu/download/54037994/0006-8993_2877_2990075-020170802-2990-1wucij6.pdf
- Povl Krogsgaard-Larsen, Erik Falch, Orla M. Larsson, Arne Schousboe: GABA uptake inhibitors: relevance to antiepileptic drug research. In: Epilepsy Research, Jg. 1987, S. 77–93. https://doi.org/10.1016/0920-1211(87)90012-X