Harnstoffnitrat
Harnstoffnitrat (chemische Struktur H2N–CO–NH2·HNO3) ist das haut- und schleimhautreizende, explosive Harnstoffsalz der Salpetersäure.[2]
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
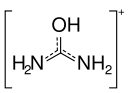 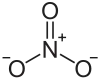 | ||||||||||
| Allgemeines | ||||||||||
| Name | Harnstoffnitrat | |||||||||
| Summenformel | CH5N3O4 | |||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 123,07 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,69 g·cm−3[2] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
schlecht in kaltem und gut in warmem Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Harnstoffnitrat kann durch vorsichtiges Eintragen einer gesättigten Harnstofflösung in Salpetersäure und anschließendem Abfiltrieren der ausfallenden Kristalle dargestellt werden. Da die Reaktion besonders bei hoher Säurekonzentration stark exotherm verlaufen kann, sollte man bei der Synthese von Harnstoffnitrat immer auf eine ausreichende Kühlung des Reaktionsgemisches achten.
Eigenschaften
Physikalische Eigenschaften
Harnstoffnitrat bildet farblose Kristalle mit einem Schmelzpunkt von 152 °C, die zu explosivem Zerfall neigen.
| Bildungsenergie | −4454,8 kJ/kg[3] |
| Bildungsenthalpie | −4575,7 kJ/kg[3] |
| Sauerstoffbilanz | −6,5 %[3] |
| Stickstoffgehalt | 34,14 %[3] |
| Normalgasvolumen | 910 l/kg[3] |
| Explosionswärme | 3213 kJ/kg (H2O (l)) 2458 kJ/kg (H2O (g))[3] |
| Spezifische Energie | 755 kJ/kg (77,0 mt/kg)[3] |
| Bleiblockausbauchung | 270 cm3/10 g[3] |
| Verpuffungspunkt | 186 °C[3] |
| Stahlhülsentest | keine Reaktion bei 1 mm Durchmesser[3] |
| Schlagempfindlichkeit | keine Reaktion bis 50 Nm Schlagenergie[3] |
| Reibempfindlichkeit | keine Reaktion bis 353 N Stiftbelastung[3] |
Chemische Eigenschaften
Da Harnstoffnitrat das Salz einer schwachen Base und einer starken Säure ist, reagiert es in wässriger Lösung sauer. Es ist in heißem Wasser gut löslich.
Gemische mit Magnesiumpulver können spontan unter starker Wärme- und Gasentwicklung (u. a. NOx) reagieren. Ähnliche gefährliche Reaktionen sind auch von Mischungen mit anderen unedlen Metallen sowie weiteren Reduktionsmitteln zu erwarten.
Harnstoffnitrat neigt zur explosiven Zersetzung besonders in Anwesenheit von Katalysatoren, wie Schwermetallionen, aber auch durch Reibung oder Wärme.[2] Mittels DSC wurde ab 145 °C eine stark exotherme Zersetzungsreaktion mit einer Zersetzungswärme von −350 kJ·mol−1 bzw. −2840 kJ·kg−1 gemessen.[4]
Verwendung
Harnstoffnitrat wird in bis zu fünfprozentiger wässriger Lösung aufgrund der in der Lösung freiwerdenden Salpetersäure als Metallreinigungs- oder Beizmittel verwendet. Aufgrund der enthaltenen Salpetersäure eignet sich Harnstoffnitrat als Reaktant für Sprengstoffe. Im Nahen Osten wird es vermehrt von Attentätern direkt als Sprengstoff genutzt; es entwickelt nämlich, wenn es initial gezündet wird, 70 Prozent der Sprengkraft von TNT, ist allerdings beträchtlich billiger und leichter herzustellen. Aufgrund seiner Wasserlöslichkeit und vor allem wegen seiner korrosiven Wirkung und seiner thermischen Instabilität (Zersetzung schon ab 152 °C) ist es jedoch als militärischer Sprengstoff ungeeignet und findet neben seinem unprofessionellen Einsatz bei Anschlägen nur wenig Verwendung.
Rechtliches
Harnstoffnitrat ist trocken oder mit weniger als 20 % Massenanteil Wasser ein Explosivstoff im Sinne von Artikel 1 Abs. 2 und 3 der Richtlinie 93/15/EWG und des Sprengstoffgesetzes.[5]
Literatur
- Roland Ionas Bialke: Das Lehrbuch der Sprengmeister. Gesammeltes Wissen über Sprengstoffe aus der klandestinen Hobby-Sprengmeisterzene, Books on Demand GmbH, Norderstedt 2008, ISBN 978-3-8370-4729-5.
Weblinks
- Sprengstoffproduktion im Nahen Osten
- Über die physiko-chemiche Eigenschaft des Harnstoffnitrats (abgerufen am 14. Mai 2020)
- Der lebensgefährliche Leichtsinn „Internet-Bombenbau“ (abgerufen am 14. Mai 2020)
- Gesetz über explosionsgefährliche Stoffe (abgerufen am 14. Mai 2020)
- Detektion und Identifizierung von Sprengstoffen mit chemischen Schnelltests (abgerufen am 14. Mai 2020)
Einzelnachweise
- Eintrag zu Harnstoffnitrat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- Eintrag zu Harnstoffnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Josef Köhler, Rudolf Meyer, Axel Homburg: Explosivstoffe. 10. Auflage, Wiley-VCH, 2008, ISBN 978-3-527-32009-7, S. 155. doi:10.1002/9783527623402.ch8
- T. Grewer: Thermal Hazards of Chemical Reactions, Industrial Safety Series Vol. 4, Elsevier Amsterdam, 1994, ISBN 0-444-89722-4, S. 388.
- Gesetz über explosionsgefährliche Stoffe (Sprengstoffgesetz - SprengG), Anlage III Explosivstoffliste nach § 3 Abs. 1 Nr. 1 pdf (Memento vom 16. Februar 2016 im Internet Archive)
