Mikrobielle Nanodrähte
Mikrobielle Nanodrähte (englisch Bacterial nanowires or microbial nanowires) elektrisch leitfähige fädige Zellanhänge mit einem Durchmesser von ca. 10 nm. Sie werden von einer ganzen Reihe von Bakterien produziert, insbesondere von Deltaproteobacteria der Gattung Geobacter und marinen Gammaproteobacteria der Gattung Shewanella (Alteromonadaceae).[2][3] Leitfähige Zellanhänge wurden auch bei dem Cyanobakterium Synechocystis sp. PCC6803 und einer thermophilen, methanogenen Mischkultur aus Pelotomaculum thermopropionicum und Methanothermobacter thermautotrophicus nachgewiesen.[3]
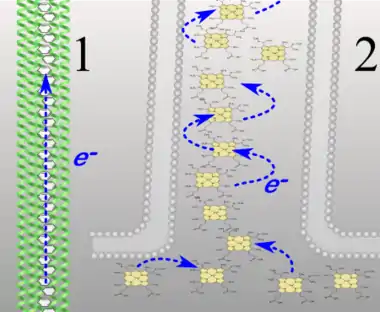
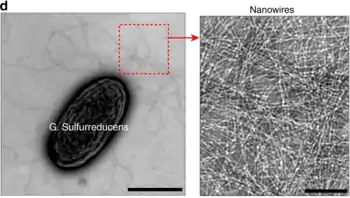
Bei den Zellanhängen von Geobacter handelt es sich um modifizierte Pili, mit denen sich die Zellen mit externen Elektronenakzeptoren wie Eisen(III)-oxid verbinden können. Das ermöglicht ihnen, durch die Oxydation von vorhandenen Elektronendonatoren ein Membranpotenzial aufzubauen, das für die chemiosmotische ATP-Synthese genutzt wird. Entdeckt wurde dieser Mechanismus anhand von Geobacter-Mutanten, deren Pili zwar an Eisenoxyd binden, aber nicht in der Lage zu dessen Reduktion waren.[2] Ihre Leitfähigkeit beruht auf delokalisierten π-Elektronen von aromatischen Aminosäuren.[1] (Siehe Abbildung)
Die Nanodrähte von Bakterien der Gattung Shewanella haben einen grundsätzlich anderen Aufbau. Es handelt sich nicht um Pili, sondern um Ausstülpungen der Periplasmamembran, die eine Länge von bis zu 9 µm erreichen.[4] In ihnen sind Häm-Moleküle angereichert, und zwar die Cytochrome MtrC und OmcA.[5][6] Ihr Nachweis in der Äußeren Membran und der Verlust der Leitfähigkeit bei Mutanten mit MtrC und OmcA -Defekt[7] lässt vermuten, dass die Leitfähigkeit der Shewanella Nanodrähten auf diesen Cytochromen beruht.[8][9] Es wurde ein an Elektroden verifizierter Mechanismus vorgeschlagen, nach dem ein Elektronen-„Hopping“ (Hüpfen) zwischen den gelösten Cytochromen die Leitfähigkeit bewirkt[1][10] (siehe Abbildung). 2020 entwickelten Forscher mit Hilfe der leitfähigen mikrobiellen Nanodrähten von Geobacter sulfurreducens einen „Memristor“, der bei elektrischen Spannungen von weniger als 100 mV funktioniert. Der „Memory Transistor“ erlaubt den Betrieb durch Aktionspotenziale von natürlichen Neuronen und kann Biosensor-Signale lokal verarbeiten. Die Technologie könnte für Gehirn-inspiriertes Computing und direkte Kommunikation mit biologischen Gehirnzellen eingesetzt werden.[11][12]
Nanodrähte können in Biofilmen Elektronen über relativ weite Entfernungen übertragen[13] und sich dort auch an andere Mikroorganismen andocken.[3][14][15]
Einzelnachweise
- Nikhil S. Malvankar, Derek R. Lovley: Microbial nanowires for bioenergy applications. In: Current Opinion in Biotechnology. Juni 2014, Band 27. S. 88–95, doi:10.1016/j.copbio.2013.12.003
- Gemma Reguera, Kevin D McCarthy, Teena Mehta, Julie S Nicoll, Mark T Tuominen, Derek Lovley: Extracellular electron transfer via microbial nanowires. In: Nature. 435, Nr. 7045, 2005, S. 1098–1101. doi:10.1038/nature03661.
- Yuri A. Gorby, Svetlana Yanina, Jeffrey S. McLean, Kevin M. Rosso, Dianne Moyles, Alice Dohnalkova, Terry J. Beveridge, In Seop Chang, Byung Hong Kim, Kyung Shik Kim, David E. Culley, Samantha B. Reed, Margaret F. Romine, Daad A. Saffarini, Eric A. Hill, Liang Shi, Dwayne A. Elias, David W. Kennedy, Grigoriy Pinchuk, Kazuya Watanabe, Shun’ichi Ishii, Bruce Logan, Kenneth H. Nealson, and Jim K. Fredrickson: Electrically conductive bacterial nanowires produced by Shewanella oneidensis strain MR-1 and other microorganisms. In: Proceedings of the National Academy of Sciences. 103, Nr. 30, 2006, S. 11358–11363. doi:10.1073/pnas.0604517103.
- Ai Lin Chun: Bacterial nanowires: An extended membrane. In: Nature Nanotechnology. 9, Nr. 10, 2014, S. 750. doi:10.1038/nnano.2014.230.
- Sahand Pirbadian, Sarah E. Barchinger, Kar Man Leung, Hye Suk Byun, Yamini Jangir, Rachida A. Bouhenni, Samantha B. Reed, Margaret F. Romine, Daad A. Saffarini, Liang Shi, Yuri A. Gorby, John H. Golbeck: Shewanella oneidensis MR-1 nanowires are outer membrane and periplasmic extensions of the extracellular electron transport components. In: Proceedings of the National Academy of Sciences. 111, Nr. 35, 2014, S. 12883–12888. doi:10.1073/pnas.1410551111.
- Marian Breuer, Piotr Zarzycki, Liang Shi, Thomas A. Clarke, Marcus J. Edwards, Julea N. Butt, David J. Richardson, James K. Fredrickson, John M. Zachara, Jochen Blumberger, Kevin M. Rosso: Molecular structure and free energy landscape for electron transport in the decahaem cytochrome MtrF. In: Biochemical Society Transactions. 40, Nr. 6, 2012, S. 1108–1203. doi:10.1042/BST20120139.
- Mohamed Y. El-Naggar, Greg Wanger, Kar Man Leung, Thomas D. Yuzvinsky, Gordon Southam, Jun Yang, Woon Ming Lau, Kenneth H. Nealson, Yuri A. Gorby: Electrical transport along bacterial nanowires from Shewanella oneidensis MR-1. In: Proceedings of the National Academy of Sciences. Band 107, Nr. 42. 19. Oktober 2010, S. 18127–18131, ISSN 0027-8424, doi:10.1073/pnas.1004880107
- Nicholas F. Polizzi, Spiros S. Skourtis, David N. Beratan: Physical constraints on charge transport through bacterial nanowires. In: Faraday Discuss. Band 155. S. 43–61, doi:10.1039/C1FD00098E.
- Sarah M. Strycharz-Glaven, Rachel M. Snider, Anthony Guiseppi-Elie, Leonard M. Tender: On the electrical conductivity of microbial nanowires and biofilms. In: Energy & Environmental Science. Band 4, Nr. 11, doi:10.1039/C1EE01753E.
- Sahand Pirbadian and Mohamed Y. El-Naggar: Multistep hopping and extracellular charge transfer in microbial redox chains. In: Phys. Chem. Chem. Phys.,. 14, 2012, S. 13802–13808. doi:10.1039/C2CP41185G.
- Researchers unveil electronics that mimic the human brain in efficient learning (en). In: phys.org. Abgerufen am 17. Mai 2020.
- Tianda Fu, Xiaomeng Liu, Hongyan Gao, Joy E. Ward, Xiaorong Liu, Bing Yin, Zhongrui Wang, Ye Zhuo, David J. F. Walker, J. Joshua Yang, Jianhan Chen, Derek R. Lovley, Jun Yao: Bioinspired bio-voltage memristors. In: Nature Communications. 11, Nr. 1, 20. April 2020, S. 1861. bibcode:2020NatCo..11.1861F. doi:10.1038/s41467-020-15759-y. PMID 32313096. PMC 7171104 (freier Volltext).
- Reguera et al.: Biofilm and nanowire production leads to increased current in Geobacter sulfurreducens fuel cells. In: Appl. Environ. Microbiol. 72: 2006. S. 7345–8.
- Korneel Rabaey, René A. Rozendal: Microbial electrosynthesis – revisiting the electrical route for microbial production. In: Nature Reviews Microbiology. 8, Nr. 10, 2010, ISSN 1740-1526, S. 706–716. doi:10.1038/nrmicro2422.
- Amelia-Elena Rotaru, Pravin M. Shrestha, Fanghua Liu, Toshiyuki Ueki, Kelly Nevin, Zarath M. Summers, Derek R. Lovley: Interspecies Electron Transfer via Hydrogen and Formate Rather than Direct Electrical Connections in Cocultures of Pelobacter carbinolicus and Geobacter sulfurreducens. In: Applied and Environmental Microbiology. 78, Nr. 21, 2012, S. 7645–7651. doi:10.1128/AEM.01946-12.