Wagner-Meerwein-Umlagerung
Bei der Wagner-Meerwein-Umlagerung handelt es sich um eine Namensreaktion in der Organischen Chemie. Sie wurde 1899 in Kasan (Russland) von Georg Wagner (Егор Егорович Вагнер)[2] entdeckt und ab 1914 von Hans Meerwein[3][4] untersucht. Sie ist eine intramolekulare Umlagerung von Atomen oder Molekülgruppen in Carbeniumionen.

_2.png.webp)
Übersichtsreaktion
Es handelt sich um eine durch Säuren katalysierte, nucleophile [1,2]-Umlagerung des Kohlenstoffgerüsts über Carbeniumionen. Diese Art von Umlagerung nennt man auch anionotrope Umlagerung. Da bei der Reaktion eine σ-Bindung wandert, handelt es sich um einen sigmatropen Prozess.[5] Dabei sind R1 und R2 Organylreste oder Wasserstoffatome und R3 sind verschiedene Organylreste.
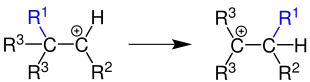
Mechanismus
Der in der Übersichtsreaktion abgebildete Umlagerungsschritt kann nicht separat durchgeführt werden. Er ist stets ein Teil von Reaktionssequenzen. Reaktionen, bei denen diese Umlagerungen stattfinden, bestehen im Wesentlichen aus drei Schritten: [6]
- Zunächst wird ein Carbeniumion erzeugt (beispielsweise bei Eliminierungsreaktionen oder bei Nucleophilen Substitutionen)
- Dieses Carbeniumion wird im nächsten Schritt stabilisiert. Dies ist die Reaktionssequenz, in der die [1,2]-Umlagerung stattfindet.
- Im letzten Schritt entsteht beispielsweise durch Eliminierung eines Protons oder durch einen nucleophilen Angriff das Reaktionsprodukt.
Die Triebkraft solcher Umlagerungen ist die Bildung stabilerer Carbeniumionen. Bei der Stabilisation von Carbeniumionen werden die positiven Ladungen durch mehr Alkylreste in Nachbarschaft besser stabilisiert (vgl. Hyperkonjugation).[6] D. h. tertiäre Carbeniumionen sind stabiler als sekundäre bzw. primäre.
Voraussetzungen
Damit eine Umlagerung stattfinden kann, muss eine gute Abgangsgruppe (z. B. protonierbare Hydroxygruppe oder Halogenid) an einem Kohlenstoffatom vorliegen, das selbst an ein höher substituiertes Kohlenstoffatom gebunden ist.
Umlagerung einer Alkylgruppe
Der Mechanismus der Umlagerung einer Alkylgruppe am Beispiel einer Eliminierungsreaktion:

Durch die Abspaltung eines Halogenids aus einem Halogenalkan 1 wird ein sekundäres Carbeniumion 2 erzeugt. Da dieses im Vergleich zu tertiären Carbeniumionen weniger stabil ist, lagert sich eine Alkylgruppe (hier blau markiert) um. Dadurch entsteht die Zwischenstufe 3. Im letzten Schritt wird dieses tertiäre Carbeniumion 3 deprotoniert und es bildet sich das Alken 4.
Hydridverschiebung
Am folgenden Beispiel (Isomerisierung eines Halogenalkans) wird die [1,2]-Umlagerung eines Hydridions verdeutlicht. Bei der Reaktion handelt es sich um eine Nucleophile Substitution bei der ein primäres zu einem sekundären Halogenalkan reagiert. Dies wird auch Isomerisierung genannt.

Die Hydridverschiebung verläuft grundsätzlich analog zur Umlagerung einer Alkylgruppe (s. o.). Durch den Einsatz von Aluminiumbromid in katalytischen Mengen wird die Abgangsgruppe (in diesem Fall Bromid) abgespalten und aus dem Bromalkan 1 wird ein primäres Carbeniumion 2 erzeugt. An dem positiv geladenen Kohlenstoffatom ist ein höher substituiertes Kohlenstoffatom gebunden, nämlich ein sekundäres. Somit kann eine Wagner-Meerwein-Umlagerung stattfinden. Das Carbeniumion 2 reagiert zu der Zwischenstufe 3, indem ein Hydridion (hier blau markiert) umgelagert wird. So entsteht ein sekundäres Carbeniumion 3, welches durch die nucleophile Abgangsgruppe angegriffen wird und zu dem Isomer der Ausgangsverbindung, einem sekundären Bromalkan 4, weiterreagiert.
Verwendung
Das synthetische Potential der Wagner-Meerwein-Umlagerung ist naturgemäß gering und ist ansonsten im Labor häufig eher eine unerwünschte Nebenreaktionen – beispielsweise bei Eliminierungsreaktionen.[6] Jedoch hat sie eine besondere Bedeutung in der Terpenchemie.
Terpenchemie
Die Wagner-Meerwein-Umlagerung ist bei der Dehydratisierung von Tetrahydrofurfurylalkohol zu Dihydropyran hilfreich.[7] Des Weiteren kommen Wagner-Meerwein-Umlagerungen in der Biosynthese des Cholesterols vor.[8]
| Tipp: Bei Umlagerungsreaktionen mit komplexeren Molekülen, ist es hilfreich, die Kohlenstoffatome der Edukte und Produkte mit Ziffern zu versehen. So werden die Unterschiede der Verbindungen hervorgehoben. Die Ziffern beziehen sich nicht auf die Nummerierung des Stammsystems nach der IUPAC-Nomenklatur. |
Außerdem spielt sie eine große Rolle bei der Herstellung von Camphenen. Camphen ist ein Zwischenprodukt der Synthese für Geschmacks- und Geruchsstoffen.
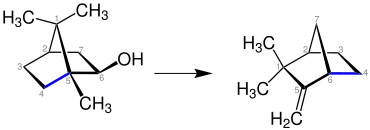
Es handelt sich hierbei um eine säurekatalysierte Dehydratation von Isoborneol zu Camphenen (vgl. dazu die Eliminierungsreaktion zur Umlagerung von Alkylresten, siehe oben). Anzumerken ist, dass das Produkt in der hier dargestellten Form im Vergleich zum Edukt zur besseren Übersichtlichkeit im Raum gedreht wurde. Man beachte hier die Nummerierung der Kohlenstoffatome. Die blaumarkierte Bindungen zwischen zwei Kohlenstoffatomen stellt die Wanderung der Organylreste dar.
Der Mechanismus sieht wie folgt aus:[9]
 Mechanismus der Dehydratisierung von Isoborneol (Teil 1)
Mechanismus der Dehydratisierung von Isoborneol (Teil 1)
Zunächst wird das Isoborneol (1) dehydratisiert, wodurch das Carbeniumion 2 erzeugt wird. Dieses sekundäre Kation ist instabiler als das tertiäre Kation 3. Dies ist die Reaktionssequenz in der die Wagner-Meerwein-Umlagerung stattfindet. Dazu wird das Ringsystem aufgebrochen und eine neue Bindung zwischen zwei Kohlenstoffatomen entsteht – eine Alkylgruppe wird umgelagert. Die Verbindung 3 wird hier in zwei Darstellungsweisen abgebildet. Durch Drehungen im dreidimensionalen Raum ist die rechte Struktur aus der linken entstanden.
 Mechanismus der Dehydratisierung von Isoborneol (Teil 2)
Mechanismus der Dehydratisierung von Isoborneol (Teil 2)
An dem stabilisierten Carbeniumion 3 wird ein Wasserstoffatom eliminiert und es resultiert das Camphen (4) mit der Doppelbindung.
Sonstiges
Die Wagner-Meerwein-Umlagerung ähnelt der Pinakol-Umlagerung.[7] Hierbei handelt es sich ebenfalls um eine anionotrope Gerüstumlagerung des Carbeniumions und behandelt speziell Glycole, welche durch die Abspaltung von Wasser zu Ketonen reagieren. Somit kann man die Pinakol-Umlagerung als eine Sonderform der Wagner-Meerwein-Umlagerungen verstehen.
Einzelnachweise
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Eine Einführung in die organische Chemie. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 205.
- Georg Wagner: J. Russ. Phys. Chem. Soc. 31, 1899, S. 690.
- Hans Meerwein: Über den Reaktionsmechanismus der Umwandlung von Borneol in Camphen. [Dritte Mitteilung über Pinakolinumlagerungen.] In: Justus Liebigs Annalen der Chemie. Band 405, Nr. 2, 1914, S. 129–175, doi:10.1002/jlac.19144050202.
- H. Meerwein, Konrad van Emster: Über die Gleichgewichts-Isomerie zwischen Bornylchlorid, Isobornylchlorid und Camphen-chlorhydrat, Berichte der Deutschen Chemischen Gesellschaft, Band 55, 1922, S. 2500
- Reinhard Brückner: Reaktionsmechanismen: organische Reaktionen, Stereochemie, moderne Synthesemethoden. 3., aktualisierte und überarb. Auflage. Elsevier, Spektrum, Akad. Verlag, München / Heidelberg 2004, ISBN 3-8274-1579-9, S. 589–595.
- Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der organischen Chemie. 5., durchges. Auflage. Teubner, Wiesbaden 2006, ISBN 3-8351-0091-2, S. 336–338.
- H. Becker et. al.: Organikum. Organisch-chemisches Grundpraktikum. 22., vollständig überarb. und aktualis. Auflage. Wiley-VCH, Weinheim [u. a.] 2004, ISBN 3-527-31148-3, S. 666.
- Stefan Bräse, Jan Bülle, Aloys Hüttermann: Organische und bioorganische Chemie. Das Basiswissen für Master- und Diplomprüfungen. Wiley-VCH-Verl, Weinheim 2008, ISBN 978-3-527-32012-7, S. 552.
- J. Clayden, N. Greeves, S. Warren, P. Wothers: Organic chemistry. Oxford University Press, Oxford / New York 2001, ISBN 0-19-850347-4, S. 981–982.
Literatur
- L. M. Harwood: Basistexte Chemie: Polare Umlagerungen. Wiley-VCH, Weinheim 1997, ISBN 3-527-29291-8.
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9, S. 592–602.
- J. Clayden, N. Greeves, S. Warren, P. Wothers: Organic Chemistry. Oxford University Press, 2001, ISBN 0-19-850346-6, S. 981–982.