Festoxidbrennstoffzelle
Die Festoxidbrennstoffzelle (englisch solid oxide fuel cell, SOFC) ist eine Hochtemperatur-Brennstoffzelle, die bei einer Betriebstemperatur von 650–1000 °C betrieben wird. Der Elektrolyt dieses Zelltyps besteht aus einem festen keramischen Werkstoff, der in der Lage ist, Sauerstoffionen zu leiten, aber für Elektronen isolierend wirkt. Viele Festoxidbrennstoffzellen-Projekte sind noch in der Entwicklung, einige sind schon am Markt.[1][2]
Begriffe
Die Zusammenschaltung mehrerer Festoxidbrennstoffzellen wird als SOFC-Stack bezeichnet. SOFC-Anlagen umfassen darüber hinaus die Wärmetauscher, den Reformer, den Gleichstrom-Wechselstrom-Inverter, die Steuerung und sonstige Technik, die für den Betrieb nötig ist.
Prinzip
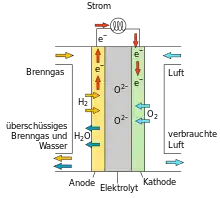
Der feste Elektrolyt ist als dünne Membran gestaltet, um die Sauerstoffionen energiearm transportieren zu können; dazu sind hohe Temperaturen notwendig. Auf den Seiten des Elektrolyts sind gasdurchlässige elektrische Leiter als Kathode und Anode angebracht. Die dem Elektrolyt abgewandte, äußere Seite der Kathode wird von Luft umgeben, die äußere Anodenseite von Brenngas. Ungenutzte Luft und ungenutztes Brenngas sowie Verbrennungsprodukte werden abgesaugt.
Die Funktion jeder galvanischen Zelle beruht auf einer Redoxreaktion, bei der Reduktion und Oxidation räumlich getrennt ablaufen, nämlich an der Grenzfläche zwischen Elektrode und Elektrolyt. In der SOFC ist diese Redox-Reaktion eine Reaktion von Sauerstoff mit dem Brennstoff, z. B. Wasserstoff oder auch Kohlenstoffmonoxid. Auf der Kathodenseite herrscht Sauerstoffüberschuss, während auf der Anodenseite Sauerstoffmangel herrscht, weil der vorhandene Sauerstoff gleich z. B. mit dem Wasserstoff reagiert. Durch dieses Konzentrationsgefälle diffundiert der Sauerstoff von der Kathode zur Anode. Der Elektrolyt dazwischen ist aber nur für Sauerstoff-Ionen durchlässig. Hat das Sauerstoffmolekül (O2) die Grenzfläche zwischen Kathode und Elektrolyt erreicht, zerfällt es unter der Aufnahme von vier Elektronen in zwei jeweils zweifach-negativ geladene Sauerstoffionen und kann so die Barriere (Ionenleiter) durchdringen. An der Anode werden zwei Wasserstoffmoleküle (H2, Brenngas), unter der Abgabe von insgesamt vier Elektronen, in vier einfach-positiv geladene Wasserstoffionen umgewandelt. An der Grenze zur Anode angekommen, reagieren die zwei Sauerstoffionen katalytisch mit den vier einfach-positiv geladenen Wasserstoffionen unter Abgabe von Wärme und den entsprechenden Verbrennungsprodukten. Voraussetzung für die Ionisation von Wasserstoff und Sauerstoff an der jeweiligen Elektrode ist ein Stromfluss, der Zweck der Festoxidbrennstoffzelle, der anderweitig genutzt werden kann.
Bei einer Spannung von etwa 0,7 V wird eine Leistungsdichte von circa 1 W/cm² (entsprechend einer Stromdichte von 1,4A/cm²) erreicht.[3] Brenngase und dazugehörige Reaktionsgleichungen siehe Abschnitt #Reaktionsgleichungen.
Das Funktionsprinzip entspricht dem einer Lambdasonde.
Bauformen

Im Wesentlichen unterscheidet man aufgrund der Bauform: tubulare (röhrenförmige, s. Abb.) und planare (flache) SOFCs. Tubulare SOFCs bieten technisch Vorteile bei der Abdichtung der Elektroden-Gasräume zueinander. Planare SOFCs eignen sich eher für Anwendungen, die hohe volumetrische Leistungsdichten erfordern. Aufgrund der tragenden Struktur wird weiterhin zwischen elektrolytgestützter und anodengestützter SOFC differenziert. Durch den Einsatz von 3D-Druckern, deren Tinte aus keramischen Partikeln und Lösungsmitteln besteht, ergibt sich die Möglichkeit unterschiedliche Bauformen zu realisieren.[3]
Technische Herausforderungen
Durch die hohe Einsatztemperatur ist es möglich, unedlere, das heißt kostengünstigere Materialien zu benutzen als zum Beispiel bei der PEMFC und gleichzeitig hohe Leistungsdichten und hohe Wirkungsgrade zu erzielen. Allerdings ist die hohe Einsatztemperatur auch der Grund für fast alle technischen Herausforderungen.
Die Dichtungstechnik der Gasräume zueinander ist sehr aufwendig (Hochtemperaturdichtung). Konventionelle Flachdichtungen versagen schlichtweg. Stoffschlüssige Verbindungen können die Elektroden kurzschließen. Daher werden spezielle Dichtungsmaterialien wie zum Beispiel Glaslote derzeit für SOFC-Anwendungen verwendet.
Mechanische Spannungen im Betrieb haben ihren Ursprung vor allem in Temperaturunterschieden in der Zelle und durch unterschiedliche thermische Ausdehnungskoeffizienten (TEC) der Materialien. Dazu kommt noch die verstärkte Neigung zu Kriech- oder Oxidationsprozessen bzw. Hochtemperaturkorrosion.
Entwicklung
Den ersten großen Schritt zu einer marktreifen SOFC tat die Firma Westinghouse Power Corporation (jetzt Siemens Power Generation) in den späten 1980er Jahren. Sie baute einen funktionsfähigen Prototyp mit einem Elektrolyt aus Yttrium-stabilisiertem Zirconiumoxid, kurz YSZ. Es wurde ein Verfahren adaptiert, die elektrochemische Gasphasenabscheidung, die dünne Schichten auf porösem Material auftragen kann, z. B. zur Herstellung der Anode. Durch die röhrenförmige Anordnung der Zellen entfiel auch die Notwendigkeit von Dichtungen. Der Wirkungsgrad war gut, der Gasphasenabscheidungsprozess war allerdings teuer und die Zellen waren für ihre Leistung noch recht groß.
Mitte der 1990er Jahre fand Tatsumi Ishihara ein neues Elektrolytmaterial, mit Strontium und Magnesium dotiertes Lanthangalliumoxid, kurz LSGM.[4][5] Es trug wesentlich dazu bei, SOFCs mit niedrigeren Temperaturen entwickeln zu können. Sie bekamen die Bezeichnung IT-SOFCs, englisch intermediate-temperature SOFCs, oder Mitteltemperatur-SOFCs. Damit können Keramikteile durch Metalle ersetzt werden, z. B. die mechanischen Verbindungen zwischen den Zellen.[6]
Materialien
Elektrolyt
SOFCs verwenden Elektrolyte aus fester Oxidkeramik, typischerweise Yttrium-stabilisiertes Zirkonoxid, genauer Yttriumoxid-teilstabilisiertes oder Yttriumoxid-vollstabilisiertes Zirconiumdioxid. Alternativ wird strontium- und magnesiumdotiertes Lanthangalliumoxid (LSGM) oder selten mit Gadolinium dotiertes Ceroxid verwendet.
Zur Herstellung einer dünnen Elektrolytschicht aus YSZ wird eine Beschichtung mit feinem YSZ-Staub auf einer Elektrode aufgetragen und gesintert. Die Beschichtung kann wie erwähnt durch elektrochemische Gasphasenabscheidung erfolgen. Gegebenenfalls können auch mehrere Lagen co-gesintert werden, etwa der Elektrolyt und eine Elektrode. Keramik, z. B. eine Elektrode, kann auch durch Foliengießen und Brennen vorgefertigt werden und dann mit anderen Schichten im ausreichend heißen Ofen co-gesintert werden.[7]
Kathode
Die Kathode eines YSZ-Elektrolyts ist klassischerweise aus dem keramischen Werkstoff Lanthan-Strontium-Manganit, (La,Sr)MnO3, kurz LSM. Es kann noch zusätzlich mit Yttrium-stabilisiertem Zirkoniumoxid (YSZ) vermischt sein, um den Ausdehnungskoeffizienten zu beeinflussen.[8][9] Vor allem für Niedertemperatur-SOFCs kommen auch Lanthan-Strontium-Kobaltit, (La,Sr)CoO3, LSC, dasselbe mit Eisen, LSF, oder die Kombination LSCF infrage. Allerdings scheint eine Trennschicht aus einer Cerverbindung zum YSZ-Elektrolyt notwendig, um schädlichen chemische Prozessen entgegenzuwirken.[10]
Die Kathode eines LSGM-Elektrolyts ist normalerweise aus Samarium-Strontium-Kobaltit (Sm,Sr)CoO3, kurz SSC.
Reaktionsgleichungen
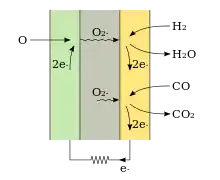
Brennstoffzellen können theoretisch jede ausreichend reaktionsfreudige Redox-Reaktion umsetzen, wenn die Ausgangsstoffe flüssig oder gasförmig sind.[11] Feste Brennstoffe müssen entweder separat[12] oder in der Brennstoffzelle zu Flüssigkeiten oder Gasen umgesetzt werden. Beispielsweise kann Koks bei ausreichend hoher Temperatur in einer geeigneten SOFC genutzt werden, da er mit dem Reaktionsprodukt CO2 zu Kohlenmonoxid umgesetzt werden kann.[13]
Praktisch konzentriert man sich zumeist auf Brennstoffe, die leicht verfügbar sind. Bei SOFCs sind das vor allem die Gase Wasserstoff und Synthesegas. Wasserstoff ist sehr reaktionsfreudig und kann leicht hergestellt werden, insbesondere in Verbindung mit Kohlenstoffmonoxid wie im Synthesegas. So können Erdgas, Rohöldestillate, oder sogar Hackschnitzel[12] für SOFCs aufbereitet werden. Oxidationsmittel ist der Sauerstoff der Luft.
| Reaktionsgleichungen 1 | Reaktionsgleichungen 2 | |
|---|---|---|
| Anode | Oxidation / Elektronenabgabe | Oxidation / Elektronenabgabe |
| Kathode | Reduktion / Elektronenaufnahme | Reduktion / Elektronenaufnahme |
| Gesamt- reaktion | Redoxreaktion / Zellreaktion | Redoxreaktion / Zellreaktion |
Der innere Ladungstransport erfolgt mittels O2−-Ionen. Auf der Kathodenseite benötigt die SOFC Sauerstoff und produziert an der Anode Wasser und/oder CO2.
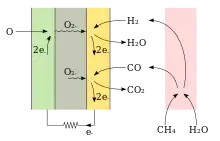
Die Festoxidbrennstoffzelle direkt mit Methan zu betreiben, führt zu Problemen mit der Pyrolyse von CH4 und den daraus resultierenden Kohlenstoffablagerungen.
| Anode | Oxidation / Elektronenabgabe |
|---|---|
| Kathode | Reduktion / Elektronenaufnahme |
| Gesamt- reaktion | Redoxreaktion / Zellreaktion |
Es gibt auch SOFCs, die Ammoniak als Brennstoff nutzen. Für die Reaktionsgleichungen und andere Details siehe Ammoniak-Brennstoffzelle.
Wirkungsgrad
Im Unterschied zu Wärmekraftmaschinen mit nachgeschaltetem Generator wie z. B. Gaskraftwerken, die die chemische Energie in Wärme, Kraft und dann in Strom umwandeln, wird in Brennstoffzellen der Strom (neben Wärme) direkt erzeugt. Damit ist ihr Wirkungsgrad nicht durch die thermodynamischen Grenzen des Carnot-Prozesses begrenzt, und der theoretische Wirkungsgrad ist sehr hoch. Ein Grund für die praktischen Grenzen der erreichbaren Wirkungsgrade liegt darin, dass zur optimalen Nutzung der relativ teuren Brennstoffzellen Mindeststromdichten angestrebt werden, die wiederum eine ausreichende Zufuhr von Brennstoff und Abfuhr der Abgase erfordern. Da die Verbrennungsprodukte an der Anode (z. B. CO2 und/oder H2O) an derselben Stellen auftreten, wo auch die Brenngase (H2, CH4, CO) benötigt werden, ist eine Vermischung nur schwer vermeidbar. Man könnte zwar die Gasströme verlangsamen oder die Elektrodenfläche vergrößern, um die Umsetzungen vollständiger und die Wirkungsgrade höher zu machen, aber die Stromdichte und die Leistung der Zelle wäre dann zu gering. Daher wird das Brenngas so eingeblasen, dass ein Teil unverbrannt aus der Zelle kommt. Die entsprechende Energie verringert den Wirkungsgrad der Zelle.
Interessant ist diese Anwendung insbesondere für den Power-to-Gas-Prozess, der mit herkömmlicher Technik nur relativ niedrige Wirkungsgrade aufweist. Mit reversibel betriebenen Festoxidbrennstoffzellen sind hingegen Strom-zu-Strom-Wirkungsgrade bis etwa 70 % möglich, womit der Wirkungsgrad in etwa vergleichbar mit Pumpspeicherkraftwerken ist.[14] Die revers-arbeitende SOFC ist die SOEC.
Literatur
- Manuel Ettler: Einfluss von Reoxidationszyklen auf die Betriebsfestigkeit von anodengestützten Festoxid-Brennstoffzellen. Forschungszentrum Jülich, 2008, ISBN 978-3-89336-570-8, S. 120 (eingeschränkte Vorschau in der Google-Buchsuche).
Weblinks
- Fuel Cell Handbook (Seventh Edition) ab Seite 7–1, umfangreiche wissenschaftliche Übersicht, Firma EG&G Technical Services, Inc. (englisch, PDF, 5 MiB)
- MeMO – Elektrochemische Metall-Metalloxid-Hochtemperaturspeicher für zentrale und dezentrale stationäre Anwendungen, Präsentationsgrafiken eines laufenden Projekts, Forschungszentrum Jülich, abgerufen 2014
- SOFC Status and Challenges Präsentation einer SOFC mit Bildern, Chris De Minco & Dr. Subhasish Mukerjee, Firma Delphi Automotive Systems, 2001
Einzelnachweise
- Development status and future prospects for residential and commercial use of SOFC systems (englisch), Minoru Suzuki von der Firma Osaka Gas Co. Ltd. - SOFC Hersteller sind beispielsweise die Firma Osaka Gas Co. Ltd. selbst, in Japan, sie macht eine 700 Watt SOFC, die Firma Ceres Power, GB, ebenfalls 700 Watt, oder die Firma Bloom Energy, USA, ein 100 kW Gerät.
- Alberto Varone, Michele Ferrari, Power to liquid and power to gas: An option for the German Energiewende. In: Renewable and Sustainable Energy Reviews 45, (2015), 207–218, S. 209, doi:10.1016/j.rser.2015.01.049.
- 3D-Printed Solid Oxide Fuel Cells from High Particle Content Liquid Inks, abgerufen am 9. Dezember 2014.
- Tatsumi Ishihara, Hideaki Matsuda, Yusaku Takita. Doped LaGaO3 Perovskite Type Oxide as a New Oxide Ionic Conductor. J.Am. Chem. Soc. 116. 3801–3803. 1994
- Synthese und Charakterisierung keramischer Schichten aus (La,Sr)(Ga,Mg)O3-x, Thorsten Maldener
- Fuel Cell Handbook (Seventh Edition) ab Seite 7–1, umfangreiche wissenschaftliche Übersicht, Firma EG&G Technical Services, Inc. (englisch, PDF, 5 MiB), ISBN 978-0-387-77707-8, 2009
- Low Cost Fabrication Processes for Solid Oxide Fuel Cells Abschnitt Cathode Tape Production, Präsentation, M.M. Seabaugh.., Firma NexTech Materials Ltd., 2000. Verfahren für YSZ Schicht auf LSM Substrat.
- Funktion der Hochtemperatur-Brennstoffzelle (Memento des Originals vom 5. November 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., kurze Einführung, Welt der Physik
- Einführung in die Hochtemperaturbrennstoffzelle (SOFC), kurze Einführung, Institut für Technische Thermodynamik des Deutschen Zentrums für Luft- und Raumfahrt
- Perovskite Oxide for Solid Oxide Fuel Cells Kapitel 2: Overview of Intermediate-Temperature Solid Oxide Fuel Cells, Seite 28, umfangreiche wissenschaftliche Übersicht, von Tatsumi Ishihara (Verleger), Chapter 2 von Harumi Yokokawa, Springer, 2009
- A.J. Appleby, F.R. Foulkes, Fuel Cell Handbook, Van Nostrand Reinhold, New York, NY, 1989. zitiert in: Fuel Cell Handbook, EG&G
- Biomasse-KWK-Technologie für den Mittleren Leistungsbereich, basierend auf einer Festbrennstoff-Vergasertechnik sowie einer Festoxid-Brennstoffzelle (SOFC). In: Forschung > laufende Projekte. Wuppertal Institut für Klima, Umwelt, Energie gGmbH, abgerufen am 23. April 2019.
- Yong-min Xie, Jiang-lin Li, Jin-xing Hou, Pei-jia Wu, Jiang Liu: Direct use of coke in a solid oxide fuel cell. In: Journal of Fuel Chemistry and Technology. Band 46, Nr. 10, Oktober 2018, S. 1168–1174, doi:10.1016/S1872-5813(18)30048-3.
- Jensen et al., Large-scale electricity storage utilizing reversible solid oxide cells combined with underground storage of CO2 and CH4. In: Energy and Environmental Science (2015), doi:10.1039/c5ee01485a.