Cholesterin-Monooxygenase
Die Cholesterin-Monooxygenase (P450scc) (auch: 20,22-Desmolase, Cholesterindesmolase) ist das Enzym, das die Umwandlung von Cholesterin zu Pregnenolon katalysiert. Dieser Reaktionsschritt ist unentbehrlich in der Biosynthese von Steroidhormonen in Wirbeltieren. Im Menschen ist das Enzym an der Innenwand von Mitochondrien in den Gonaden, den Nebennieren und im Gehirn lokalisiert. Mutationen im CYP11A1-Gen können zu P450cc-Mangel und dieser zu adrenaler Insuffizienz führen.[1][2]
| Cholesterin-Monooxygenase | ||
|---|---|---|
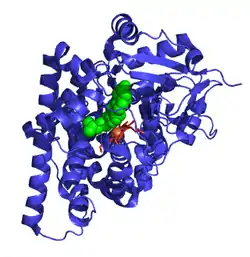 | ||
| Kristallstruktur von menschlichem Cytochrom P450 11A1 als Komplex mit Cholesterin nach PDB 3n9y | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 482 Aminosäuren | |
| Kofaktor | Häm-Thiolat | |
| Bezeichner | ||
| Gen-Name | CYP11A1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.14.15.6, Monooxygenase | |
| Reaktionsart | Zwei Oxidationen, eine Abspaltung | |
| Substrat | Cholesterin + 3 • Ferredoxin(red) + 3 • O2 | |
| Produkte | Pregnenolon + Isocapronsäure + 3 • Ferredoxin(oxy) + 3 • H2O | |
| Vorkommen | ||
| Übergeordnetes Taxon | Wirbeltiere | |
Varianten des Enzyms sind möglicherweise mit erhöhtem Risiko für und rezidivem Verlauf von Prostatakrebs assoziiert. Eine frühere Assoziation von Varianten des CYP11A1-Promoters mit dem Auftreten des polyzystischen Ovarialsyndrom konnte nicht bestätigt werden.[3][4]
Katalysierte Reaktion
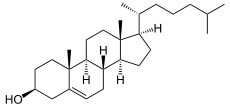 + O2 ⇒
+ O2 ⇒ 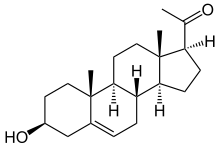 + H2O
+ H2O
Cholesterin wird zu Pregnenolon umgewandelt. Als Substrat wird außerdem Vitamin D3 akzeptiert, als Produkt entsteht 20(OH)-D3, welches Keratinozyten zur Teilung veranlasst.[5][6]
Weblinks
- Jassal/D'Eustachio/reactome.org: Oxidation of cholesterol to 22beta-hydroxycholesterol
- Jassal/D'Eustachio/reactome.org: Oxidation of 22beta-hydroxycholesterol to 20alpha,22beta-hydroxycholesterol
- Jassal/D'Eustachio/reactome.org: 20alpha,22beta-hydroxycholesterol is cleaved by CYP11A1 to yield pregnenolone and isocaproaldehyde
Einzelnachweise
- UniProt P05108
- Kim CJ, Lin L, Huang N, et al: Severe combined adrenal and gonadal deficiency caused by novel mutations in the cholesterol side chain cleavage enzyme, P450scc. In: J. Clin. Endocrinol. Metab.. 93, Nr. 3, März 2008, S. 696–702. doi:10.1210/jc.2007-2330. PMID 18182448. PMC 2266942 (freier Volltext).
- Celhar T, Gersak K, Ovcak Z, Sedmak B, Mlinaric-Rascan I: The presence of the CYP11A1 (TTTTA)6 allele increases the risk of biochemical relapse in organ confined and low-grade prostate cancer. In: Cancer Genet. Cytogenet.. 187, Nr. 1, November 2008, S. 28–33. doi:10.1016/j.cancergencyto.2008.08.003. PMID 18992638.
- Gaasenbeek M, Powell BL, Sovio U, et al: Large-scale analysis of the relationship between CYP11A promoter variation, polycystic ovarian syndrome, and serum testosterone. In: J. Clin. Endocrinol. Metab.. 89, Nr. 5, Mai 2004, S. 2408–13. PMID 15126571.
- Tuckey RC, Li W, Zjawiony JK, et al: Pathways and products for the metabolism of vitamin D3 by cytochrome P450scc. In: FEBS J.. 275, Nr. 10, Mai 2008, S. 2585–96. doi:10.1111/j.1742-4658.2008.06406.x. PMID 18410379.
- Zbytek B, Janjetovic Z, Tuckey RC, et al: 20-Hydroxyvitamin D3, a product of vitamin D3 hydroxylation by cytochrome P450scc, stimulates keratinocyte differentiation. In: Journal of Investigative Dermatology. 128, Nr. 9, September 2008, S. 2271–80. doi:10.1038/jid.2008.62. PMID 18368131.