Epothilone
Epothilone sind 16-gliedrige Makrolide, die 1987 erstmals aus dem Myxobakterium Sorangium cellulosum von Gerhard Höfle und Hans Reichenbach an der ehemaligen Braunschweiger Gesellschaft für Biotechnologische Forschung (GBF, heute Helmholtz-Zentrum für Infektionsforschung) isoliert wurden.[1] Aufmerksamkeit erregte der Naturstoff, als die zu Paclitaxel analoge Wirkung auf Tumorzellen festgestellt wurde und so das Interesse als Leitstruktur für die Krebsforschung geweckt wurde.
Substanzen
| Epothilone | ||||||||
| Name | Epothilon A | Epothilon B | Epothilon C | Epothilon D | Epothilon E | Epothilon F | ||
| Strukturformel |  Epothilon A (R = H) bzw. B (R = CH3) |
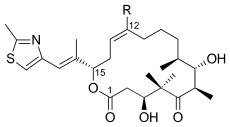 Epothilon C (R = H) bzw. D (R = CH3) |
 Epothilon E (R = H) bzw. F (R = CH3) | |||||
| CAS-Nummer | 152044-53-6 | 152044-54-7 | 189453-10-9 | |||||
| PubChem | 448799 | 448013 | 9891226 | 447865 | ||||
| Summenformel | C26H39NO6S | C27H41NO6S | C26H39NO5S | C27H41NO5S | C26H39NO7S | C27H41NO7S | ||
| Molare Masse | 493,66 g·mol−1 | 507,68 g·mol−1 | 477,66 g·mol−1 | 491,68 g·mol−1 | 509,66 g·mol−1 | 523,68 g·mol−1 | ||
| Aggregatzustand | fest[2][3] | |||||||
| Kurzbeschreibung | weißes Pulver | |||||||
| Wirkstoffklasse | Zytostatikum | |||||||
| Wirkmechanismus | Stabilisierung der Mikrotubuli | |||||||
| GHS- Kennzeichnung[4] |
| |||||||
| H-Sätze | siehe oben | |||||||
| P-Sätze | siehe oben | |||||||
Geschichte
Das erste Epothilon wurde 1987 an der damaligen Gesellschaft für Biotechnologische Forschung in Braunschweig isoliert und die Struktur aufgeklärt. Die Patentierung erfolgte dann 1993. Beachtung gewannen die Strukturen erst, als in einem in vitro-Screening beim amerikanischen National Cancer Institute (NCI) die außergewöhnlich hohe Wirkung auf Brust- und Dickdarm-Tumorzellen festgestellt wurde. Als dann noch der Paclitaxel-artige Wirkmechanismus bekannt wurde und die Tatsache, dass Epothilon Paclitaxel von dem Target verdrängt, also die stärkeren Wechselwirkungen besitzt, wurde Epothilon für die pharmazeutische Forschung interessant. Das Patent wurde aber bereits vorher aufgegeben. Auf der Basis dieser Leitstruktur wurden zum einen mit Hilfe kombinatorischer Methoden, basierend auf den Totalsynthesen und zum anderen durch chemisches Derivatisieren der mikrobiell gebildeten Epothilone, sowohl Struktur-Wirkungsbeziehungen (SAR) als auch später dann hoffnungsvolle Wirkstoffkandidaten entwickelt, die sich heute in klinischen Phasen bzw. kurz vor der Markteinführung befinden.
Der Name Epothilon leitet sich von den Strukturelementen Epoxid, Thiazol und Keton ab.
Pharmakologische Wirkung
Die Epothilone besitzen eine antifungische Wirkung gegen Oomyceten. Diese Wirkung geht aber einher mit einer erheblichen phytotoxischen Wirkung, so dass die Verbindungen dort heute nicht mehr von Interesse sind.
Eine beachtenswerte pharmakologische Wirkung besitzen die Epothilone als Zytostatika. Die Wirkung beruht in der Stabilisierung der Mikrotubuli, einem Wirkmechanismus den bislang nur Paclitaxel gezeigt hat. Alle anderen bis dahin bekannten Mikrotubuli-aktiven Wirkstoffe (Colchicin, Podophyllotoxin und Vinblastin) destabilisieren die Mikrotubuli, die an der Zellteilung und an der Proteinsekretion beteiligt sind. Durch die Störung der Mikrotubuli wird die mitotische Zellteilung gestört, und die Geschwulst wächst nicht weiter.[5]
Epothilon soll vor allem gegen Paclitaxel-resistente Tumoren verwendet werden. Gegenüber Paclitaxel sind synthetische Epothilon-Derivate, bedingt durch ihre wesentlich höhere Löslichkeit in Wasser, bis zu dreißigmal wirksamer. Dies hat auch den Vorteil, dass es bei der Verabreichung als Wirkstoff in wässriger Lösung ohne Lösungsvermittler zu weniger Nebenwirkungen im Vergleich zu den Taxanen führt. Nach einer aktuellen Einschätzung (März 2009) der Europäischen Arzneimittelagentur scheint dies nicht der Fall zu sein. Besonders die hohe Zahl von Neuropathien (Nervenschädigungen) führte zur Ablehnung.
Gegenüber den Wirkstoffen, die auf dem Paclitaxel als Leitstruktur aufbauen, haben die Epothilone den Vorteil, dass bei ihnen nur eine geringe Neigung zur Ausbildung von Resistenzen besteht.
Aktueller Stand der Entwicklung zum Wirkstoff
Eine Reihe pharmazeutischer Unternehmen haben Wirkstoffe auf der Basis von Epothilon entwickelt. Bristol-Myers Squibb wurde im Oktober 2007 die Zulassung des Epothilon-Derivates Ixabepilon (Handelsnamen: Ixempra) für die USA erteilt. In der Europäischen Union wurde das Medikament durch die Europäische Arzneimittel-Agentur (EMA) nicht zugelassen. Das Committee for Medicinal Products for Human Use (CHMP) der EMA, sah ein im Vergleich zum Nutzen des Medikaments ein zu hohes Risiko für die Patienten, insbesondere wegen der möglichen Entwicklung von Neuropathien bei der Einnahme von Ixempra.[6][7]
2005 wurde von der damaligen Schering AG (jetzt Bayer HealthCare Pharmaceuticals) berichtet, dass sie den Wirkstoff Sagopilon (interner Name ZK-EPO), der auf der Struktur von Epothilon beruht, in die Klinische Phase I gebracht haben.
Von der Novartis AG wurde Patupilon (interner Name EPO906) bis zur klinischen Phase III entwickelt, die Substanz hat aber in mehreren klinischen Studien keine signifikante lebensverlängernde Wirkung gezeigt und eine Zulassung wurde nicht beantragt.[8]
Gewinnung
Die Gewinnung aus Fermenterkulturen des Myxobakteriums Sorangium cellulosum ist neben drei Totalsynthesen von herausragender Bedeutung.
Totalsynthese
Fast zeitgleich wurden von Samuel Danishefsky von der Colombia University und kurze Zeit später von Kyriacos Costa Nicolaou vom kalifornischen Scripps-Institut und von Dieter Schinzer von der Technischen Universität Braunschweig Totalsynthesen für Epothilone publiziert. Aufgrund der Aktualität von Epothilon wurden in späteren Arbeiten noch von Johann Mulzer und Erick M. Carreira weitere Totalsynthesen veröffentlicht. Das künstlich hergestellte Epothilon kann durch die erheblich teurere Totalsynthese allerdings nicht mit den natürlichen, in Fermentern hergestellten konkurrieren.
Biosynthese
Epothilon B ist ein 16-gliedriges Polyketid mit einer Methylthiazol-Gruppe als Seitenkette, welche über ein Olefin an das Makrolacton gebunden ist. Das polykedische Makrolacton wird durch eine Typ I Polyketidsynthase (PKS), und der Thiazolring aus einem Cystein durch eine nichtribosomale Peptidsynthetase (NRPS) hergestellt. Während der Biosynthese benutzen sowohl PKS als auch NRPS Carrier Proteine, welche nach dem Auslesen der genetischen Informationen aus der DNA, also post-translational, durch Phosphopanthetein-Gruppen modifiziert wurden, um an die wachsende Kette zu binden. PKS benutzt den Coenzym-A-Thioester um die Reaktion zu katalysieren und verändert das Substrat durch selektive Reduktion der β-Carbonyl-Gruppe zu einer Hydroxygruppe (Ketoreduktase, KR), dem Alken (Dehydratase, DH) und dem Alkan (Enoylreduktase, ER). PKS-I ist ebenfalls in der Lage, den α-Kohlenstoff des Substrates zu methylieren. NRPS benutzt Aminosäuren, die am Enzym aktiviert wurden, zum Amino-acyladenylieren. Die Synthese von Epothilon B beginnt mit einem 2-Methyl-4-carboxythiazol Baustein, welcher durch die translationale Kupplung zwischen PKS, dem EPOS A (epoA)-Baustein und NRPS bzw. EPOS p(epoP)-Bausteinen gebildet wird. Das EPOS A trägt eine modifizierte β-Ketoacylsynthase (Malonyl-ACP Decarboxylase, KSQ), eine Acetyltransferase (AT), eine Enoylreduktase (ER) und eine Acylcarrierprotein-Domaine. Das EPOS P enthält eine Domain für die Bildung des Heterocyclus, zur Adenylierung eine Oxidase und die Domaine zur Thiolisierung. Diese Domains sind wichtig, weil sie an der Bildung des 5-Ringes des Thiazol-Heterocyclus beteiligt sind. Das EPOS P aktiviert das Cystein und bindet das aktivierte Cystein an das Aminoacyl-S-PCP. Wenn das Cystein einmal gebunden ist, bringt das EPOS A eine Acetat-Einheit in den EPOS P-Komplex. Dies löst die Bildung des Thiazol-Ringes durch eine intramolekulare Cyclodehydrierung aus. Ist der 2-Methylthiazol-Ring gebildet, wird dieser von PKS EPOS B (epoB), EPOS C (epoC), EPOS D (epoD), EPOS E (epoE) und EPOS F (epoF) für eine aufeinander folgende Verlängerung übernommen, um die Doppelbindung bzw. das Epoxid auszubilden. Bemerkenswert ist hier, dass die Synthese der geminalen Dimethylgruppe nicht durch zwei sukzessive Dimethylierungen, sondern ein Derivat der Propionat-Wachstumseinheit entsteht, während aber die zweite Methyl-Gruppe durch eine Methyltransferase eingeführt wird.
Literatur
- Übersichtsartikel in: Bernd Buchmann, Ulrich Klar: Ullmann’s Encyclopädia of Industrial Chemistry; Epothilones. Wiley-VCH Verlag, Weinheim, doi:10.1002/14356007.k09_k01.pub2.
Einzelnachweise
- G. Höfle, N. Bedorf, H. Steinmetz, D. Schomburg, K. Gerth, H. Reichenbach: In Angew. Chem.: 108,1996, 1671–1673. Epothilon A und B - neuartige, 16gliedrige Makrolide mit cytotoxischer Wirkung: Isolierung, Struktur im Kristall und Konformation in Lösung. doi:10.1002/ange.19961081342.
- Datenblatt (−)-Epothilone A, from bei Sigma-Aldrich, abgerufen am 27. Dezember 2012 (PDF).
- Datenblatt (−)-Epothilone B, from bei Sigma-Aldrich, abgerufen am 27. Dezember 2012 (PDF).
- In Bezug auf ihre Gefährlichkeit wurde die Substanz von der EU noch nicht eingestuft, eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- McQueney, J. Zhu, O. Hensens, L. Kopal, J. Liesch, M. Goetz, E. Lazarides, C. M. Woods: Epothilones, a New Class of Microtubule-stabilizing Agents with Taxol-like Mechanismus of Action. In: Cancer Research Band 55, S. 2325–2333, PMID 7757983.
- Questions and answers on the withdrawal of the marketing authorisation for Ixempra. (PDF; 43 kB).
- F&A zur Ablehnung durch die Europäischen Arzneimittelagentur (PDF; 52 kB).
- Pressemitteilung Novartis vom 27. Mai 2010 (Memento vom 7. April 2014 im Internet Archive) Pressemitteilung Novartis vom 27. Mai 2010.
Weblinks
- Dieter Schinzer, Anja Limberg: Epothilone: Neue Wirkstoffe gegen Krebs (PDF; 154 kB) Magdeburger Wissenschaftsjournal, 1/2000
- Bettina Frank, Rolf Müller: Wie Mikroorganismen den Krebs bekämpfen helfen. Pharmazeutische Zeitung online