Entdeckung der Radioaktivität
Die Entdeckung der Radioaktivität war ein Meilenstein in der Entwicklung der modernen Physik.
Ausgangssituation
Im ausgehenden 19. Jahrhundert bestand noch weitgehend ein geschlossenes newtonsches Weltbild. Zwar hatte Antoine Henri Becquerel das bis dahin unbekannte Phänomen entdeckt, dass Uran und Uransalze eine Schwärzung fotografischer Emulsion auslösen konnten, aber diese Entdeckung blieb weitgehend unbekannt. Niemand hatte eine Vorstellung von Atomkernen. Das Wort Radioaktivität und deren eigentliche Ursache waren unbekannt und damit auch die möglichen biologischen Auswirkungen.
Das Arbeiten im Labor war umständlicher und gefährlicher, als heutige Techniken mit elektronischen Hilfsmitteln vermuten lassen: Lösungen wurden mit der Hand gerührt, und für Wiegevorgänge standen mechanische Waagen mit einer Genauigkeit von 0,1 mg zur Verfügung. Auch Vakuumpumpen wurden mit der Hand bedient und das so erzeugte Vakuum war verglichen mit heute üblichen Vakua eine Million Mal schwächer.
Periodensystem der Elemente
| H 1 |
He 2 | ||||||||||||||||
| Li 3 |
Be 4 |
B 5 |
C 6 |
N 7 |
O 8 |
F 9 |
Ne 10 | ||||||||||
| Na 11 |
Mg 12 |
Al 13 |
Si 14 |
P 15 |
S 16 |
Cl 17 |
Ar 18 | ||||||||||
| K 19 |
Ca 20 |
Sc 21 |
Ti 22 |
V 23 |
Cr 24 |
Mn 25 |
Fe 26 |
Co 27 |
Ni 28 |
Cu 29 |
Zn 30 |
Ga 31 |
Ge 32 |
As 33 |
Se 34 |
Br 35 |
Kr 36 |
| Rb 37 |
Sr 38 |
Y 39 |
Zr 40 |
Nb 41 |
Mo 42 |
Tc* 43 |
Ru 44 |
Rh 45 |
Pd 46 |
Ag 47 |
Cd 48 |
In 49 |
Sn 50 |
Sb 51 |
Te 52 |
J 53 |
X 54 |
| Cs 55 |
Ba 56 |
La 57 |
Hf* 72 |
Ta 73 |
W 74 |
Re* 75 |
Os 76 |
Ir 77 |
Pt 78 |
Au 79 |
Hg 80 |
Tl 81 |
Pb 82 |
Bi 83 |
Po* 84 |
At* 85 |
Rn* 86 |
| Fr* 87 |
Ra* 88 |
Ac* 89 |
Th 90 |
Pa* 91 |
U 92 |
||||||||||||
| Lanthanoide: | La 57 |
Ce 58 |
Pr 59 |
Nd 60 |
Pm* 61 |
Sm 62 |
Eu* 63 |
Gd 64 |
Tb 65 |
Dy 66 |
Ho 67 |
Er 68 |
Tm 69 |
Yb 70 |
Lu* 71 |
* Anmerkung: Die blau dargestellten Elemente: 43, 61, 63, 71, 72, 75, 84 bis 89 und 91 sind damals noch unbekannt.
Uran
Das damals mit der Ordnungszahl 92 letzte Element des Periodensystems Uran wurde 1789 vom deutschen, damals in Berlin lebenden Chemieprofessor und Apotheker Martin Heinrich Klaproth entdeckt. Es ist nach dem Planeten Uranus benannt, der acht Jahre zuvor (1781) von Friedrich Wilhelm Herschel entdeckt worden war. Klaproth isolierte es als Oxid; Eugène Peligot gelang 1841 die Herstellung als reines Uranmetall.
Bedeutung hatte es neben seinem Wert für die Chemie hauptsächlich in Form seiner Verbindungen als Farbstoff. Die Gewinnung geschah durch Extrahieren aus der in St. Joachimsthal natürlich vorkommenden Pechblende.
Die Entdeckung Becquerels
Antoine Henri Becquerel entdeckte Anfang 1896 bei dem Versuch, die gerade gefundene Röntgenstrahlung durch Fluoreszenz zu erklären,[1] dass Uransalz (welches nach Belichtung fluoresziert) fotografische Platten zu schwärzen vermochte. Bei den ersten Versuchen war immer eine Anregung durch Sonnenlicht vorausgegangen. Durch eine Änderung des Wetters konnte Becquerel die Uranpräparate nicht belichten, ließ sie aber auf der durch schwarzes Papier geschützten Fotoplatte liegen. Mehr zufällig entwickelte er auch diese Platten und entdeckte am 1. März[2] gleiche Schwärzung wie bei Fluoreszenz. Diese war damit als Ursache für die Strahlung ausgeschlossen.
Radioaktivität
Ehepaar Curie

Marie Curies Forschungen im Bereich der Radioaktivität begannen 1897. Sie selbst schrieb: „Es galt also, die Herkunft der übrigens sehr geringen Energie zu untersuchen, die von dem Uran in Form von Strahlung ständig ausgesandt wurde. Die Erforschung dieser Erscheinung erschien uns ungewöhnlich interessant, um so mehr, da dieses Problem neu war und noch nirgends beschrieben worden war. Ich beschloß, mich der Bearbeitung dieses Themas zu widmen. Ich mußte einen Ort zum Durchführen der Experimente finden. Pierre Curie erhielt vom Direktor der Schule die Genehmigung, zu diesem Zweck die verglaste Arbeitsstätte im Erdgeschoß zu benutzen, die als Lager und Maschinensaal diente.“
Im Rahmen ihrer von Pierre Curie angeregten Doktorarbeit überprüfte sie die Ergebnisse von Becquerel und maß die durch die Strahlung der Uran-Präparate verursachte Ionisierung der Luft mit Hilfe der Entladung eines Kondensators, dessen Spannung (Ladezustand) mit einem Galvanometer gemessen wurde.[3] Durch die Ionisierung der Luft entlud sich der Kondensator. So waren erste quantitative Aussagen zur Strahlung möglich. Es dauerte nicht lange, bis sie festgestellt hatte: Je größer der Urananteil war, desto intensiver war die Strahlung. Chemische Verbindungen, Druck oder Temperatur hatten keinen Einfluss.
Damit hatte sie die Strahlung als Atomeigenschaft des Urans nachgewiesen. Im Gegensatz zu Becquerel untersuchte sie allerdings nicht nur Uran-Präparate, sondern auch andere Minerale, wobei sie noch bei Thorium eine ähnliche Aktivität feststellte, ihr allerdings in der Veröffentlichung der deutsche Chemiker Gerhard Carl Schmidt zuvorkam. In der Veröffentlichung Sur une nouvelle substance fortement radio-active contenue dans la pechblende prägten Marie und Pierre Curie erstmals den Begriff radioaktiv.[4]
Für diese und die folgenden Arbeiten, die zur Entdeckung neuer viel stärker strahlender Elemente führten, erhielten die Curies 1903 zusammen mit Antoine Henri Becquerel den Nobelpreis für Physik.
Messapparatur

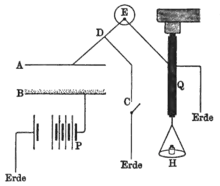
A, B Plattenkondensator
C Schalter
E Elektrometer
H Schale für Gewichte
P Batterie
Q Piezoelektrischer Quarz
Die Apparatur von Curie zur Messung der Radioaktivität wurde im Labor von Marie Curie nachgebaut (linkes Bild). Der Schaltplan rechts basiert auf einer Skizze von Marie Curie. In der Mitte auf dem Labortisch (linkes Bild) steht ein Kondensator. Seine etwa 8 cm großen horizontal liegenden Platten (A und B, Bezeichnungen im Schaltplan) werden vom silbernen Zylinder verdeckt. Eine Batterie (P, nicht im Bild) lädt die Platten über den Schalter (C) auf. Der Stromkreis ist über eine gemeinsame Masseleitung (franz. terre) geschlossen. Ein Galvanometer (E, ein Quadrantenelektrometer), rechts im Bild auf dem Holzfuß, überwacht den Ladezustand. Der Strom wird aber nicht direkt am Galvanometer abgelesen, sondern dieses wird als „Nullinstrument“ benutzt (so dass keine besondere Eichung erforderlich ist), nachdem eine zweite Spannungsquelle (Q), rechts auf dem Foto, zur Kompensation der Kondensator-Entladung angelegt wurde. Diese Spannungsquelle besteht aus einem durch ein Gewicht belasteten Quarzkristall (Piezoelektrizität), die Kompensationsspannungen lassen sich an den Gewichten ablesen.[5]
Eine definierte Menge radioaktiver Substanz wird auf die Kondensatorplatten gestreut. Je schneller sich die Platten anschließend durch Ionisation der Luft entladen, desto größer ist die Radioaktivität.
Stärkere Strahler als das Uran selbst
Bei Messungen an Mineralien, die Uran und Thorium enthielten, fand sie eine bedeutend stärkere Radioaktivität, als nach den Mengen des Urans und Thoriums zu erwarten war. Marie Curie überprüfte dies, indem sie Kupferuranylphosphat (Chalkolith) künstlich herstellte und mit dem natürlich vorkommenden Chalkolith verglich, das viel stärker strahlte. Sie schloss daraus, dass in der Pechblende und anderen Uranmineralien Elemente enthalten sein mussten, die eine viel höhere Radioaktivität als das Uran besaßen. Am 12. April 1899 gab Marie Curie in einer Mitteilung an die Akademie der Wissenschaften bekannt, dass „zwei Uraniummineralien, Pechblende (Uranit) und Chalcolit (Kupferuranylphosphat) viel aktiver sind als das Uranium selbst. Diese Tatsache ist bemerkenswert und lässt darauf schließen, dass die Minerale ein weitaus aktiveres Element als Uranium enthalten können.“ Zu diesem Zeitpunkt war nicht bekannt, dass es in Wirklichkeit zwei aktivere Elemente in den Uranproben gab. Als Nächstes machte sich das Ehepaar Curie daran, diese Elemente zu isolieren. Sie begannen 1898 mit 100 Gramm Pechblende und schieden die inaktiven Elemente mit klassischen chemischen Techniken aus.
Entdeckung des Poloniums
Mit einer für das Element Bismut typischen Fällung erhält sie ein Präparat, das mehrere hundertmal stärker strahlte als der von ihr geschaffene Uranoxid-Standard. Zu Ehren ihrer Heimat nennt sie es Polonium.
Poloniumisotope sind Zwischenprodukte der Uran-Radium-Reihe, wobei letztere das häufigste Isotop 210 des Poloniums produziert. Polonium kann daher bei der Aufarbeitung von Pechblende gewonnen werden (1000 Tonnen Uranpechblende enthalten etwa 0,03 Gramm Polonium)[6]. Dabei reichert es sich zusammen mit Bismut an. Von diesem Element kann man es anschließend mittels fraktionierter Fällung der Sulfide trennen, denn Poloniumsulfid ist schwerer löslich als Bismutsulfid.
Am Polonium gelang den Curies 1899 auch die Entdeckung der Halbwertszeit radioaktiver Elemente, sie beträgt dort nur 140 Tage, bei den anderen untersuchten Elementen waren die Halbwertszeiten dagegen zu lang, um von ihnen beobachtet werden zu können.
Entdeckung des Radiums
Am 21. Dezember 1898 finden die Curies zusammen mit dem Chemiker Gustave Bémont ein weiteres radioaktives Element, das sie in einer Barium-Fraktion angereichert hatten. Sie nennen es Radium, „das Strahlende“. Der Physiker Eugène-Anatole Demarçay konnte das neue Element spektroskopisch bestätigen. Wie Polonium ist es Teil der Uran-Blei Zerfallsreihe und deshalb in Uranmineralien vorhanden. Ein wichtiger Unterschied zum Polonium ist die scheinbar gleich bleibende Aktivität. Die des Po klingt in 140 Tagen auf die Hälfte ab, eine Halbwertszeit von 1600 Jahren wie beim Ra war mit den damaligen Mitteln nicht messbar.
In den Jahren 1899–1902 stand die Reindarstellung des Radiums an, was sich als erheblich schwieriger als beim Polonium erwies und mit Hilfe der fraktionierten Kristallisation gelang. Aus den Verarbeitungsrückständen der Pechblende löste sie hierzu das Bariumchlorid in heißem destillierten Wasser und kochte die Lösung so lange ein, bis sich erste Kristalle zeigten. Beim Abkühlen kristallisierte dann ein Teil des Bariumchlorids aus, es bildeten sich am Boden der Schale schöne, festhaftende Kristalle (Fraktion A; Kopffraktion), von denen die überstehende Mutterlauge nach dem Erkalten leicht abgegossen werden konnte. Die Mutterlauge wurde dann in einer zweiten (kleineren) Schale wieder bis zur Sättigung eingedampft. Nach dem Abkühlen und Dekantieren (Abgießen der Mutterlauge) erhielt sie die Kristallfraktion B (Schwanzfraktion). Beim Vergleich der Aktivität beider Kristallfraktionen stellte M. Curie fest, dass die Fraktion A ungefähr fünfmal stärker radioaktiv war als Fraktion B. Der Grund hierfür ist die geringere Wasserlöslichkeit von Radiumchlorid gegenüber Bariumchlorid, es wurde deshalb (obwohl es in nur unwägbar kleinsten Mengen in der Lösung vorhanden war) in der ersten Kristallfraktion des Bariumchlorids durch Mitfällung angereichert.
Schon die heute primitiv erscheinende Messung der Aktivität mit einem Elektroskop reichte aus, um die Mengenunterschiede deutlich zu machen.
M. Curie musste diesen Vorgang (Lösen, Eindampfen, Auskristallisieren, Dekantieren) unzählige Male und an immer wieder neuen Mengen von radiumhaltigem Bariumchlorid wiederholen, um schließlich einige Milligramm bariumfreies Radium zu erhalten. Im Zusammenhang mit der Anreicherung sind noch folgende Hinweise von M. Curie interessant:
Verwendet man zur Lösung des Barium-Radium-Chlorids anstatt Wasser verdünnte oder gar starke Salzsäure, so wird die Löslichkeit beider Chloride verringert und der Trenneffekt zwischen beiden Komponenten außerdem beträchtlich vergrößert; die Anreicherung des Radiums in der Kopffraktion ist also erheblich größer als bei einer wässrigen Lösung. Noch größer ist die Anreicherung des Radiums in der Kopffraktion, wenn die Isolierung des radiumhaltigen Bariums aus den Pechblenderückständen nicht mit Barium- und Radiumchlorid, sondern in Form ihrer Bromide (also mit Bariumbromid + Radiumbromid) erfolgt.
Zusammen mit André Louis Debierne isolierte sie 1910 reines Radium durch Elektrolyse einer Radiumchloridlösung. In Deutschland leistete der Braunschweiger Chemiker Friedrich Giesel Pionierarbeit bei der Darstellung von Radiumsalzen und allgemein in der Radioaktivitätsforschung, beispielsweise gelang ihm 1902 unabhängig von Debierne die Entdeckung des Actiniums.

Ein quantitatives Problem
Üblich war in der Chemie, ein neu entdecktes Element erst dann als gesichert anzunehmen, wenn es in reiner Form dargestellt werden und seine Atommasse angegeben werden konnte (eine andere Möglichkeit war die Identifizierung der Spektrallinien). Dazu mussten wägbare Mengen vorliegen. Diese konnten aus den wenigen Kilogramm Pechblende aber nicht gewonnen werden.
Die Académie des sciences wandte sich an die österreichische Akademie der Wissenschaften mit der Bitte um Hilfe durch Überlassen der als wertlos geltenden Abraumhalden von Sankt Joachimsthal, aus denen der Urananteil schon entfernt war (Uran wurde damals in der Glasindustrie verwendet und war für die Curies zu teuer). Nach Vermittlung durch den berühmten Geologen Eduard Suess erfüllten diese den Wunsch, lediglich die Transportkosten mussten von den Curies übernommen werden. In einer ersten Lieferung erhielten sie rund 1 Tonne,[7] dem allerdings später weitere Lieferungen folgten. Im Nachhinein betrachtet betrug der Wert durch das extrem teure Radium (ein mg hätte etwa 1 500 € gekostet)[8] rund 150.000 Euro.[9] Schon unter normalen Umständen enthielt die Joachimsthaler Pechblende nur 200 mg Radium pro Tonne,[10] in den Rückständen war noch viel weniger.
Marie Curie stand vor der Aufgabe, von dem aus den Rückständen bereits isolierten radiumhaltigen Bariumchlorid (etwa 8 kg BaCl2 pro Tonne Verarbeitungsrückstände) das Radium in wägbaren Mengen vom Barium abzutrennen, um es spektralanalytisch untersuchen und seine Atommasse bestimmen zu können. Die einzelnen Schritte sind im Kapitel Entdeckung des Radiums beschrieben. Da Marie körperlich kräftiger als ihr Mann Pierre war, übernahm sie den größeren Teil der Arbeit mit den schweren Gefäßen der immer umfangreicher werdenden Mengen an Lösungen.
Ein weiteres Problem war das beim Zerfall des Radiums entstehende radioaktive Gas Radon, das leicht entwich, das Laboratorium verseuchte und die Messungen auch durch seine Zerfallsprodukte (Polonium) störte. Hinzu kam, dass es gesundheitsschädlich war – das Zerfallsprodukt Polonium lagerte sich als Alphastrahler in der Lunge ab.
Durch extreme Anstrengungen, unter widrigen äußeren Umständen, gelang es den Curies, eine wägbare Menge von Radium herzustellen (etwa 100 mg),[11] deren Aktivität mehr als eine Million Mal höher war als die des ursprünglichen Uranoxid-Standards, viel mehr als die Curies anfangs angenommen hatten. 1902 konnte die Atommasse von den Curies zu 225 u bestimmt werden, was dem modernen Wert sehr gut nahekommt.
Differenzierung der Strahlung
- Zur Geschichte der Alphastrahlung siehe Alphastrahlung#Forschungsgeschichte.
- Zur Geschichte der Betastrahlung siehe Betastrahlung#Forschungsgeschichte.
- Zur Geschichte der Gammastrahlung siehe Gammastrahlung#Forschungsgeschichte.
Quellen
- Karl-Erik Zimen: Strahlende Materie. Radioaktivität – ein Stück Zeitgeschichte. Bechtle, Esslingen-München 1987, ISBN 3-7628-0464-8.
- Ulla Fölsing: Marie Curie – Wegbereiterin einer neuen Naturwissenschaft, Piper 1997. ISBN 3-492-10724-9.
- Emilio Segrè: Die großen Physiker und ihre Entdeckungen, Piper, Bd. 2, ISBN 3-492-11175-0.
- Pierre Ravanyi, Monique Bordry: Die Entdeckung der Radioaktivität, in: Spektrum Dossier Radioaktivität
- Maurice Tubiana: Strahlung in der Medizin, in: Spektrum Dossier Radioaktivität
Einzelnachweise
- auf der Sitzung der Pariser Akademie der Wissenschaften am 20. Januar 1896 stellte Henri Poincaré die Ergebnisse Röntgens vor. Becquerel war anwesend und fragte nach der Herkunft der Strahlung, worauf man ihm sagte, sie kämen anscheinend vom am stärksten fluoreszierenden Teil der Entladungsröhre
- unbekannter Autor: Geschichte der Radioaktivität. Universität Wien, 29. August 1999, archiviert vom Original am 12. März 2014; abgerufen am 16. Oktober 2018 (PDF; 230 kB).
- Johannes Friedrich Diehl: Radioaktivität in Lebensmitteln. John Wiley & Sons, 2008, ISBN 978-3-527-62374-7, S. 2 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pierre Curie, Marie Curie, G. Bémont: Sur une nouvelle substance fortement radio-active contenue dans la pechblende. In: Comptes rendus hebdomadaires des séances de l'Académie des sciences. Band 127, 1898, S. 1215–1217 (archive.org).
- Dieses Verfahren der Messung kleinster Ströme wurde durch Jacques Curie, den Bruder von Pierre, entwickelt
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 635.
- Eve Curie: Madame Curie, Kapitel 13, Marie Curie Untersuchungen über die radioaktiven Substanzen, Vieweg 1904, S. 24. Sie erhielt zunächst 1 Tonne und später mehrere weitere Tonnen.
- Bei einem Preis von 300 Reichsmark pro mg von 1907 wie oben angegeben und einem Wert von rund 5 Euro pro Reichsmark (siehe Deutsche Währungsgeschichte) ergeben sich 1500 Euro pro mg.
- bei den am Ende aus dem Erz durch die Curies gewonnenen rund 100 mg ergibt sich bei 1500 Euro pro mg ein Preis von 150.000 Euro.
- Bodenstedt: Experimente der Kernphysik und ihre Deutung, Bd. 1, S. 27.
- Erwin Bodenstedt: Experimente der Kernphysik und ihre Deutung, Bd. 1, BI Verlag 1979, S. 27. Marie Curie: Untersuchungen über die radioaktiven Substanzen, Vieweg 1904, S. 35. Die nahezu reine Probe Radiumchlorids, die 1902 zur Bestimmung der Atommasse diente, wog etwa 90 mg.