Ecteinascidin 743
Ecteinascidin 743 (auch Trabectedin oder ET-743) ist ein Chemotherapeutikum zur Behandlung von Weichteilsarkomen und Eierstockkrebs. Es wird auch in klinischen Studien auf die Eignung für die Behandlung von Brust- und Prostatasarkomen untersucht.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Trabectedin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C39H43N3O11S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01CX01 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 761,84 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Entdeckung
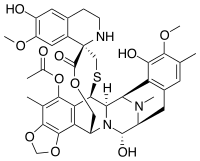
Im Jahr 1969 wurde im Rahmen eines großangelegten Untersuchungsprogramms des National Cancer Institutes von Inhaltsstoffen von Pflanzen und Meereslebewesen entdeckt, dass ein Extrakt der Seescheide Ecteinascidia turbinata antikarzinogene Eigenschaften aufwies. Die Charakterisierung der aktiven Komponente Ecteinascidin 743 erfolgte jedoch erst im Jahr 1984 durch Kenneth L. Rinehart an der University of Illinois.[2] Die Struktur von Ecteinascidin 743 ist komplex und weist drei Tetrahydroisochinolin-Einheiten, 8 Ringe, darunter ein zehngliedriger heterocyclischer Ring mit einem Cystein-Rest und sieben chiralen Zentren auf.
Eigenschaften
Trabectedin gehört neben Molekülen wie Saframycin und Safracinen zur Familie der Ecteinascidine.[3] Seine Struktur ist durch drei Tetrahydroisochinolinringe gekennzeichnet, die auch als die Untereinheiten A, B und C des Moleküls bezeichnet werden. Die Untereinheiten A und B, die miteinander verschmolzen sind, sind über eine benzylische Sulfidverknüpfung zu einer 10-gliedrigen Lactonbrücke verbunden und werden über einen Spiro-Ring an den Tetrahydro-b-Carbolinring (die Untereinheit C) angehängt. Die Untereinheiten A und B sind diejenigen, die die Bindung an Tripletts der Nebenrille der DNA herstellen, indem sie auf GC-reiche Tripletts abzielen, wobei die üblichen die Sequenzen TGG, CGG, AGC, GGC sind.[4]
Der durch das C-21 exponierte Carbonylamin-Anteil ist entscheidend für die kovalente Bindung an die exozyklische N2-Aminogruppenposition des in der Mitte des Tripletts positionierten Guanins. Diese Alkylierung basiert auf der Dehydratisierung des Carbinolamins, gefolgt von der Bildung eines Iminium-Zwischenprodukts.[4] Während die Untereinheiten A und B an der Bildung der DNA-Addukte beteiligt sind, ragt die Untereinheit C von der DNA ab und führt Interaktionen mit verschiedenen Proteinen (Transkriptionsfaktoren) durch.
Wirkungsmechanismus
Die zytostatische Wirkung von Ecteinascidin 743 beruht auf der Bindung an die Desoxyribonukleinsäure und einer Störung des Zellzyklus. Damit gehört es zur Wirkstoffklasse der Alkylanzien, zeichnet sich gegenüber den älteren Wirkstoffen dieser Klasse dadurch aus, dass es nicht an der N-7-Position von Guaninbasen, sondern an deren N-2-Position bindet.[5]
Studien
Im Vergleich zu Doxorubicin, des für die Erstlinienbehandlung zugelassenen Chemotherapeutikums, konnte mit Trabectedin eine 45%ige Reduktion des Risikos für ein Fortschreiten der Erkrankung erreicht werden, indem eine signifikante Verbesserung des progressionsfreien Überlebens gezeigt werden konnte.[6] Darüber hinaus haben Studien gezeigt, dass der Wirkstoff in Kombination mit liposomalem Doxorubicin dessen Wirkung deutlich verbessern kann.[7] In Studien mit Trabectedin wurden als Nebenwirkungen Übelkeit, Müdigkeit, Erbrechen, Diarrhö, Dyspnoe, Verstopfung, verminderter Appetit und Kopfschmerzen beobachtet.[6][8]
Synthese
Nachdem Versuche zur Züchtung der Seescheide fehlschlugen und die Ausbeute nur im ppm-Bereich lag, wurde die Arbeitsgruppe von E. J. Corey mit der Synthese des Naturstoffs beauftragt. Der Syntheseweg wurde 1996 veröffentlicht.[9] Eine vereinfachte Synthese wurde später ebenfalls in Coreys Gruppe entwickelt.[10]
Es wird angenommen, dass die Biosynthese von Ecteinascidin 743 die Dimerisierung von zwei Tyrosinresten beinhaltet, um den pentacyclischen Kern des Moleküls zu bilden. Die Strategie der Totalsynthese von E. J. Corey war inspiriert von der vorgeschlagenen Biosyntheseroute. Die Synthese nutzt solche Reaktionen wie die Mannich-Reaktion, die Pictet-Spengler-Reaktion, die Curtius-Umlagerung und eine durch einen chirale Diphosphan-Rhodiumkomplex katalysierte enantioselektive Hydrierung.
Ein anderer Syntheseweg verläuft über die Ugi-Reaktion, einer Ein-Topf-Mehrkomponentenreaktion, die für die Synthese eines komplexen Moleküls eher ungewöhnlich ist.[11]
Im Jahr 2019 wurde von Dawei Ma und Mitarbeitern eine Totalsynthese vorgestellt, welche die Synthese von Ecteinascidin 743 und dem verwandten, ebenfalls als Chemotherapeutikum genutzten, Lurbinectedin im Gramm-Maßstab ermöglicht.[12]
Handelspräparate
Yondelis (USA, EU)
Weblinks
- Yondelis auf der Website der Europäischen Arzneimittelagentur
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Kenneth L. Rinehart: Antitumor compounds from tunicates. In: Medicinal Research Reviews. 20, 2000, S. 1–27, doi:10.1002/(SICI)1098-1128(200001)20:1<1::AID-MED1>3.0.CO;2-A.
- Carmen Cuevas, Andrés Francesch: Development of Yondelis® (trabectedin, ET-743). A semisynthetic process solves the supply problem. In: Natural Product Reports. Band 26, 2009, S. 322–337, doi:10.1039/B808331M.
- Maurizio D'Incalci, Carlos M. Galmarini: A review of trabectedin (ET-743): a unique mechanism of action. In: Molecular Cancer Therapeutics. Band 8, 2010, S. 2157–2963, doi:10.1158/1535-7163.MCT-10-0263.
- G. Geisslinger, S. Menzel, T. Gundermann, B. Hinz, P. Roth (Hrsg.): Mutschler Arzneimittelwirkungen. 11. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2020, S. 858–859.
- A. Barone, D.-C. Chi, M. R. Theoret, H. Chen, K. He, D. Kufrin, W. S. Helms, S. Subramaniam, H. Zhao, A. Patel et al.: FDA Approval Summary: Trabectedin for Unresectable or Metastatic Liposarcoma or Leiomyosarcoma Following an Anthracycline-Containing Regimen. In: Clinical Cancer Research. Band 23, Nr. 24, 2017, S. 7448–7453, doi:10.1158/1078-0432.
- D'Incalci, E. Erba, G. Damia, E. Galliera, L. Carrassa, S. Marchini, R. Mantovani, G. Tognon, R. Fruscio, J. Jimeno et al.: Unique features of the mode of action of ET-743. In: The Oncologist. Band 7, Nr. 3, 2002, S. 210–216.
- E. M. Gordon, K. K. Sankhala, N. Chawla, S. P. Chawla: Trabectedin for Soft Tissue Sarcoma: Current Status and Future Perspectives. In: Advances in Therapy. Band 33, 2016, S. 1055–1071.
- E. J. Corey, David Y. Gin, Robert S. Kania: Enantioselective Total Synthesis of Ecteinascidin 743. In: Journal of the American Chemical Society. 118, 1996, S. 9202–9203, doi:10.1021/ja962480t.
- Eduardo J. Martinez, E. J. Corey: A New, More Efficient, and Effective Process for the Synthesis of a Key Pentacyclic Intermediate for Production of Ecteinascidin and Phthalascidin Antitumor Agents. In: Organic Letters. 2, 2000, S. 993–996, doi:10.1021/ol0056729.
- Atsushi Endo, Arata Yanagisawa, Masanao Abe, Shigemitsu Tohma, Toshiyuki Kan, Tohru Fukuyama: Total Synthesis of Ecteinascidin 743. In: Journal of the American Chemical Society. 124, 2002, S. 6552–6554, doi:10.1021/ja026216d.
- Dawei Ma, Weiming He, Zhigao Zhang: A scalable total synthesis of Et‐743 and lurbinectedin. In: Angewandte Chemie, International Edition. Accepted Article, 2019, doi:10.1002/anie.201900035.