Dibromdifluormethan
Dibromdifluormethan ist eine chemische Verbindung aus der Gruppe der Halogenkohlenwasserstoffe.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
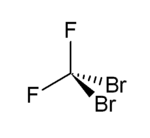 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Dibromdifluormethan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CBr2F2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 209,82 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
2,3063 g·cm−3 (15 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
24,5 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,398 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 100 ml·m−3 bzw. 860 mg·m−3[4] | |||||||||||||||
| Treibhauspotential |
280 (bezogen auf 100 Jahre)[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Dibromdifluormethan kann durch Dampfphasen-Bromierung von Difluormethan gewonnen werden.[6]
Es entsteht auch bei der Fluorierung von Tetrabrommethan.[7]
Dibromdifluormethan kann in 83 % Ausbeute als einziges Produkt durch Fluorierung von Tetrabrommethan mit Iodpentafluorid, als Hauptprodukt (relative Ausbeute 76 %) durch Fluorierung mit Brom(III)-fluorid und als Nebenprodukt (relative Ausbeute 16 %) durch Fluorierung von Tetraiodmethan mit Iodpentafluorid hergestellt werden. Die Fluorierung von Tetrabrommethan mit Titan(IV)-fluorid bildet Dibromdifluormethan in geringer Ausbeute als Gemisch mit Bromtrifluormethan. Darüber hinaus wird Dibromdifluormethan in hoher Ausbeute (81 %) durch Erhitzen von Silberbromdifluoracetat mit Brom gebildet.[8]
Eigenschaften
Dibromdifluormethan ist ein sehr leicht flüchtige, farblose Flüssigkeit, die praktisch unlöslich in Wasser ist. Sie zersetzt sich bei Erhitzung und hat ein Ozonabbaupotenzial von 1,25.[1]
Verwendung
Dibromdifluormethan wird als Löschmittel (zum Beispiel in Militärflugzeugen[9]) und als Zwischenprodukt bei der Herstellung von Farbstoffen, Pharmazeutika und quartären Ammoniumverbindungen verwendet.[6] Die Verbindung wird zurzeit nicht vom Montreal-Protokoll erfasst,[9] aber in dessen Rahmen werden in zunehmendem Maße die Quellen der in der Umwelt[10] nachgewiesenen Verbindung untersucht.[11]
Einzelnachweise
- Eintrag zu Dibromdifluormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Terry Hills: Organic Chemistry. Lotus Press, 2004, ISBN 81-89093-51-7, S. 60 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Dibromodifluoromethane, ≥95.0% (GC) bei Sigma-Aldrich, abgerufen am 24. Oktober 2021 (PDF).
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-61-6 bzw. Dibromdifluormethan), abgerufen am 2. November 2015.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- Eintrag zu Dibromodifluoromethane in der Hazardous Substances Data Bank, abgerufen am 10. März 2013 (online auf PubChem).
- Alan Roy Katritzky, Otto Meth-Cohn, Thomas Lonsdale Gilchrist, Charles Wayne Rees: Comprehensive Organic Functional Group Transformations: Carbon with Three Or ... Elsevier, 1995, ISBN 0-08-042704-9, S. 226 (eingeschränkte Vorschau in der Google-Buchsuche).
- Alan R. Katritzky, Thomas L. Gilchrist, Otto Meth-Cohn, Charles Wayne Rees: Comprehensive Organic Functional Group Transformations. Elsevier, 1995, ISBN 978-0-08-042704-1, S. 226 (eingeschränkte Vorschau in der Google-Buchsuche).
- unep.fr: UNEP DTIE OzonAction Branch: Information resources, abgerufen am 28. Mai 2015.
- Potential Ozone Depleting Substances Uses and Alternatives in the Nordic Countries. Nordic Council of Ministers, 2005, ISBN 978-92-893-1252-3, S. 41 (eingeschränkte Vorschau in der Google-Buchsuche).
- Handbook For The Montreal Protocol On Substances That Deplete The Ozone Layer. UNEP/Earthprint, 2006, ISBN 978-92-807-2770-8, S. 479 (eingeschränkte Vorschau in der Google-Buchsuche).
