Cyclopropanon
Cyclopropanon, ein Derivat von Cyclopropan, ist das erste Glied in der homologen Reihe der monocyclischen Ketone (Cycloalkanone). In seinen Eigenschaften – z. B. der vergleichsweise geringen Stabilität – unterscheidet es sich deutlich von den höheren Cycloalkanonen.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | Cyclopropanon | |||||||||
| Summenformel | C3H4O | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 56,06 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Geschichte
Der deutsche Chemiker Peter Lipp hatte um 1930 die Idee, Cyclopropanon aus Keten und Diazomethan zu synthetisieren. Seine Motivation ist ein typisches Beispiel für die Denkweise eines organischen Chemikers im 20. Jahrhundert. Die Umsetzung in Diethylether führte jedoch zum Cyclobutanon. Es wurde daher vermutet, dass dieses aus dem offenbar sehr reaktiven Dreiringketon, d. h. einer Zwischenstufe (Intermediat), entstanden war. Lipp und Mitarbeiter konnten darauf durch Zugabe von Wasser das Hydrat des Cyclopropanons isolieren, welches jedoch rasch zu Propionsäure isomerisierte. Mit Methyl- und Ethylalkohol erhielten sie Cyclopropanonhalbacetale.[2]

Diese Pionierarbeiten konnten nach etwa drei Jahrzehnten mit inzwischen fortgeschrittenen Labortechniken in der holländischen Arbeitsgruppe um T. J. deBoer bestätigt werden. Ließ man Keten und Diazomethan bei −78 °C in verflüssigtem Propan oder Fluortrichlormethan/Chloroform reagieren, so konnte das Dreiringketon isoliert und untersucht werden.[3] Bei der Temperatur des flüssigen Stickstoffs (ca. −195 °C) gelagert, erwies sich Cyclopropanon als stabil. Beim "Erwärmen" auf 0 °C bildete sich in exothermer Reaktion ein Polymer. Sogar in der Gasphase tritt die Polymerisation an der Glasoberfläche ein.
In den USA erforschten Nicholas Turro und W. B. Hammond etwa zur selben Zeit die Chemie des Cyclopropanons und vor allem seiner Methylderivate.[4][5]
McGee und Mitarbeiter synthetisierten Cyclopropanon mit einer cryochemischen Technik bei −145 °C aus den flüssigen Reaktanten (Keten und Diazomethan) und studierten das Massenspektrum sowie den Zerfall des Ketons.[6]
Eigenschaften
Physikalische Eigenschaften
Aus der Analyse eines Mikrowellenspektrums ergaben sich ungleiche C–C-Bindungen im Dreiring: Während die C1–C2- bzw. C1–C3-Bindungen (147,5 pm) im Vergleich mit Cyclopropan (151 pm) verkürzt sind, ist die Bindungslänge C2–C3 (157,5 pm) erhöht. Dies steht in Einklang mit MO-theoretischen Betrachtungen und Rechnungen. Der Valenzwinkel am Carbonyl-C-Atom (C1) beträgt nur 57° 42′ und belegt die hohe Spannungsenergie (ca. 188 kJ/mol) des Moleküls. Die C=O-Bindungslänge (119,1 pm) ist relativ kurz. Das Infrarotspektrum zeigt eine C=O-Valenzschwingung von 1816 cm−1, ein Wert, der sich deutlich von dem anderer Ketone heraushebt.[7]
Zahlreiche MO-theoretische Berechnungen haben sich mit dem Cyclopropanon-Molekül befasst. Es wurde postuliert, dass Cyclopropanon mit seinen Valenztautomeren Allenoxid (Methylenoxiran) und Oxyallyl im Gleichgewicht stehen könnte. Experimentell gab es dafür bis jetzt keine Hinweise, wohl jedoch für einige substituierte Cyclopropanone (Cycloadditionen, z. B. an Furan).
Quantenchemische Berechnungen
Angeregt durch das Problem der Valenztautomerie und der Analogie zur degenerierten Umlagerung von Methylencyclopropan (Trimethylenmethan als Intermediat?) wurden mehrere MO-Rechnungen für das System Cyclopropanon/Oxyallyl/Allenoxid vorgelegt, beginnend mit der einfachen Hückel(HMO)-Betrachtung von Burr und Michael Dewar und der theoretischen Analyse von Roald Hoffmann.[8][9][10][11]
Chemische Eigenschaften
Bei der Bestrahlung von Cyclopropanon in der Gasphase tritt Photolyse zu Kohlenmonoxid und Ethen ein.
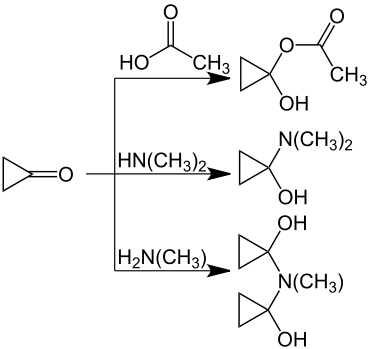
In Lösung ist Cyclopropanon – wie erwartet – sehr reaktionsfähig. Alkohole werden sehr rasch an die Carbonylgruppe addiert, z. B. Methanol. Essigsäure bildet 1-Acetoxycyclopropanol.[12] Während mit Dimethylamin das entsprechende Halbaminal (1-Dimethylaminocyclopropanol) entsteht,[13] reagiert Methylamin mit zwei Molekülen Cyclopropanon.[14]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- P. Lipp, J. Buchkremer, H. Seeles: Studien in der Cyclopropan-Reihe. Cyclo-propanon. In: Justus Liebig's Annalen der Chemie. 499, 1932, S. 1–25, doi:10.1002/jlac.19324990102.
- S. E. Schaafsma, H. Steinberg, T. J. de Boer, The synthesis of cyclopropanone, Recueil des Travaux Chimiques des Pays-Bas 85, 1170–1172 (1966), doi:10.1002/recl.19660851113.
- N.J. Turro, W.B. Hammond: Cyclopropanones—VIII. In: Tetrahedron. 24, 1968, S. 6017–6028, doi:10.1016/S0040-4020(01)90985-8.
- Nicholas J. Turro: Cyclopropanones. In: Accounts of Chemical Research. 2, 1969, S. 25–32, doi:10.1021/ar50013a004.
- E. F. Rothgery, R. J. Holt und H. A. McGee, Jr., Cryochemical Synthesis and Molecular Energies fo Cyclopropanone and Some Related Compounds, J. Amer. Chem. Soc. 97, 4971 (1975), doi:10.1021/ja00850a034.
- J. M. Pochan, J. E. Baldwin, W. H. Flygare, J. Am. Chem. Soc. 91, 1896 (1969).
- J. G. Burr, M. J. S. Dewar: The mechanism of the Favorski reaction. In: Journal of the Chemical Society (Resumed). 1954, S. 1201–1203, doi:10.1039/JR9540001201.
- R. Hoffmann, Trimethylene and the Addition of Methylene to Ethylene, J. Am. Chem. Soc. 90, 1475–1485 (1968).
- L. J. Schaad, B. A. Hess, Jr., R. Zahradnik, Ab Initio Self-Consistent-Field Study of Favorskii Rearrangement Intermediates, J. Org. Chem. 46, 1909–1911 (1981).
- J. V. Ortiz, Molecular Orbital Theory of Alkylideneoxirane-Cyclopropanone Rearrangements, J. Org. Chem. 48, 4744–4749 (1983).
- W. J. M. van Tilborg, H. Steinberg, T. J. de Boer, The chemistry of small ring compounds. Part 25. 1-Acetoxycyclopropanol, a convenient precursor for cyclopropanone, Recueil des Travaux Chimiques des Pays-Bas 93, 287–289 (1974), doi:10.1002/recl.19740931106.
- W. J. M van Tilborg, H. Steinberg, T. J. de Boer, The chemistry of small ring compounds. Part 26. The chemistry of 1-(dimethylamino)cyclopropanol, Recueil des Travaux Chimiques des Pays-Bas 93, 290–293 (1974), doi:10.1002/recl.19740931107.
- W. J. M. van Tilborg, H. Steinberg, T. J. de Boer, The chemistry of small ring compounds. Part 27. Heterocyclic condensation products from cyclopropanone and methylamine, Recueil des Travaux Chimiques des Pays-Bas 93, 294–297 (1974) doi:10.1002/recl.19740931108.
Literatur
- Nicholas J. Turro: Cyclopropanones. In: Accounts of Chemical Research. 2, 1969, S. 25–32, doi:10.1021/ar50013a004.
- Arthur Greenberg, Tyler A. Stevenson in Molecular Structure and Energetics, Vol. 3: "Studies of Organic Molecules" (Edited by Joel F. Liebman and Arthur Greenberg), S. 195–233, VCH Publishers, Deerfield Beach, 1986.