Claudine
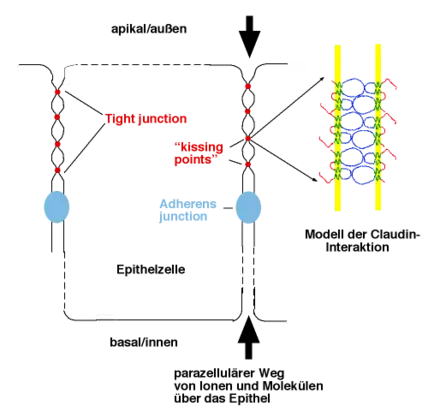
Claudine (lat. claudere „schließen“) sind eine Gruppe von Proteinen, die der wichtigste Bestandteil der in Deckgeweben (Epithelien) vorkommenden Zellverbindungen, den so genannten Tight junctions, sind. Epithelien bedecken die Körperoberflächen von vielzelligen tierischen Lebewesen und begrenzen auch das Lumen der Organe. Claudine verschließen in den Epithelien die Zwischenräume zwischen Zellen und ermöglichen eine Kontrolle des Flusses von Stoffen durch den Zellzwischenraum. Sie bilden somit eine Art Versiegelung zwischen den Zellen („parazelluläre Barriere“), die in Epithelien benötigt wird, damit Ionen und Moleküle die Organe nicht frei passieren können. Eine Aufrechterhaltung eines bestimmten Milieus einzelner Kompartimente (wie beispielsweise pH-Werte von 1 bis 2 im Magen) wäre ohne diese parazellulären Barrieren nicht möglich.
Aufbau
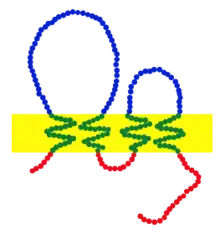
Claudine sind kleine Transmembranproteine, die in vielen Organismen vorkommen und vom Fadenwurm Caenorhabditis elegans bis hin zum Menschen in ihrem Aufbau sehr ähnlich (konserviert) sind. Sie haben eine Größe von 20–27 Kilodalton (kDa). Auf DNA-Sequenzebene ist die Konservierung jedoch nicht sehr hoch. Sie durchspannen die Zellmembran vier Mal (Tetraspanin), der N-Terminus und der C-Terminus liegen jeweils im Cytoplasma. Ein Claudin hat zwei extrazelluläre (außerhalb der Zelle gelegene) Bereiche, die als die kleinere und größere extrazelluläre Schleife bezeichnet werden. Die erste extrazelluläre Schleife besteht durchschnittlich aus 53 Aminosäuren, die zweite ist etwas kleiner und hat im Mittel 24 Aminosäuren. Der N-Terminus ist in der Regel nur sehr kurz (4–10 Aminosäuren), der C-Terminus ist in seiner Länge variabler (zwischen 21 und 63 Aminosäuren). In der ersten extrazellulären Schleife befindet sich ein Aminosäuremotiv, das in allen Claudinen vorkommt und aus den Aminosäuren W-GLW-C-C besteht. Es wird vermutet, dass sich zwischen den Cysteinen eines Claudins oder den Cysteinen verschiedener Claudine Disulfidbrücken ausbilden. Die am stärksten konservierten Bereiche sind die Transmembrandomänen, der variabelste Bereich ist der C-Terminus. Bis auf Claudin 12 besitzen alle humanen Claudine ein PDZ-Bindemotiv am C-Terminus, mit dem sie an PDZ-Domänen-Proteine binden. Für den C-Terminus konnte außerdem gezeigt werden, dass er für die Lokalisation der Claudin-Moleküle in den Tight junctions benötigt wird.[1]
Bisher wurden 27 verschiedene humane Claudine identifiziert und mit „Claudin 1“ bis „Claudin 27“ bezeichnet.[2] Sie liegen nicht in einem Cluster vor, sondern finden sich auf verschiedenen Chromosomen verteilt.
Geschichte
Seitdem die Tight junctions beschrieben wurden und man ihre Funktion für die Zellen erkannte, wurde nach Faktoren oder strukturellen Bestandteilen der Tight junctions gesucht, die für die Versiegelung der Zellzwischenräume benötigt wurden. Zu Beginn der 1990er Jahre gelang es der japanischen Forschungsgruppe um Mikio Furuse und Shoichiro Tsukita an der Universität von Kyoto, das Transmembranprotein Occludin als erstes integrales Membranprotein der Tight junction zu identifizieren. Es stellte sich jedoch heraus, dass Occludin nicht für die Bildung und Aufrechterhaltung der parazellulären Barriere verantwortlich ist, da Zellen, denen Occludin fehlt, trotzdem noch Tight-junction-Stränge ausbilden können. Dieselbe Gruppe entdeckte einige Jahre später die ersten beiden tatsächlich für die Ausbildung der Tight junctions zuständigen Proteine und gab ihnen 1998 den Namen „Claudin“, von lateinisch claudere für „schließen“.[3] Einige Claudin-Proteine wurden vorher bereits in anderen Zusammenhängen beschrieben, ihre Funktion als versiegelnde Komponenten der Tight junctions wurde jedoch zunächst nicht erkannt. Bei der Einordnung in die Gruppe der Claudine wurden sie entsprechend umbenannt.
Durch gezielte Suche im Genom von Mensch und Maus wurden bisher insgesamt 24 Proteine gefunden, die aufgrund ihrer Sequenz, Struktur und Expression in die Gruppe der Claudine geordnet werden konnten.
Auch in anderen Tierarten wurden Claudine entdeckt, so zum Beispiel in allen daraufhin untersuchten Säugetieren, in verschiedenen Fischarten (Takifugu rubripes, Danio rerio), in Amphibien (Xenopus laevis und Xenopus tropicalis) und 2003 unerwarteterweise sogar in dem Fadenwurm Caenorhabditis elegans und der Fruchtfliege Drosophila melanogaster. Unerwartet war diese Entdeckung deshalb, weil sowohl C. elegans als auch Drosophila gar keine Tight junctions, sondern analoge Strukturen, die Septate junctions, in den Zellen der Epithelien besitzen.
Seitdem wurden über 500 Studien veröffentlicht, die sich mit Claudinen, ihrer Expression, Funktion und Regulation befassen. Da sie die Kernkomponenten der Tight junctions sind, wäre ihre Manipulierbarkeit ein großer Fortschritt beispielsweise bei der Überwindung der Blut-Hirn-Schranke, die zurzeit eine medikamentöse Behandlung von Hirntumoren fast unmöglich macht.
Expression
Die Genaktivität der verschiedenen Claudine in den verschiedenen Geweben wurde bei vielen verschiedenen Modellorganismen wie Mäusen, C. elegans, Zebrafisch (D. rerio), D. melanogaster und teilweise auch beim Menschen untersucht. Jedes der 24 bekannten Claudine hat ein spezifisches Expressionsmuster. Verschiedene Untersuchungen an ektopisch exprimierten Claudinen in Zellkulturen führten zu der Annahme, dass jedes Claudin andere Eigenschaften in Bezug auf die Ladungsselektivität und vermutlich auch auf die Größenselektivität der Barriere hat. Die Kombination der verschiedenen Claudine, die in einem Epithel exprimiert werden, bestimmt die Eigenschaften der Barriere. Je nach Anforderungen an das Epithel werden Claudine exprimiert, die zu einer mehr oder weniger dichten Barriere führen.[4] Dabei gibt es Claudine, die ubiquitär, also fast in allen epithelialen Geweben, aktiv sind, wie beispielsweise Claudin 1, und andere, die sehr spezifisch exprimiert werden, entweder räumlich, wie Claudin 16, das ausschließlich im ansteigenden Teil der henleschen Schleife zu finden ist, oder zeitlich wie Claudin 6, das bei Mäusen nur während der Embryogenese exprimiert wird.
Parazelluläre Barriere
Wie die Claudine miteinander interagieren und wie die Struktur der Tight junctions auf molekularer Ebene aufgebaut ist, ist noch nicht genau bekannt. In Zellkulturexperimenten konnte gezeigt werden, dass Claudine sowohl homophile als auch spezifische heterophile Bindungen eingehen können: Zellen, die Claudin 1 exprimieren können mit Zellen, die Claudin 3 exprimieren, Tight-junction-artige Strukturen ausbilden, ebenso Claudin 2 mit Claudin 3, nicht jedoch Claudin 1 mit Claudin 2. Ein Modell schlägt vor, dass Claudine wässrige Poren (aqueous pores) bilden, die je nach Art der Claudine bestimmte Ionen und Moleküle bis zu einer bestimmten Größe durchlassen (Ladungsselektivität und Größenselektivität). Diese Eigenschaften werden von geladenen Aminosäureresten in der ersten extrazellulären Schleife bestimmt und sind Calcium-unabhängig. Mutagenese-Experimente in Zellkultur zeigten, dass die Umkehr der Ladung bestimmter Reste in der ersten extrazellulären Schleife zu einer Umkehr der Ladungsselektivität der Barriere führt.[5][6] Gemessen wird dies über den TER (transepithelial electrical resistance, transepithelialer Widerstand).
Claudin-Superfamilie
Die Familie der Claudine wird von der Pfam-Proteindatenbank des Sanger-Institutes in Cambridge, England, das Alignments von Proteinsequenzen bereitstellt, in die PMP22/EMP/MP20/Claudin-Superfamilie (pfam00822) eingeordnet.[7] Diese besteht insgesamt aus etwa 450 Proteinen aus verschiedenen Spezies, die alle eine ähnliche Struktur besitzen. Für einige dieser Proteine wurden jedoch völlig andere Funktionen als die der eigentlichen Claudine beschrieben.
Assoziierte Krankheiten
Manche Krankheiten sind mit der Veränderung von Claudinen assoziiert: Claudin 3 und 4 beispielsweise sind Rezeptoren für das Clostridium-perfringens-Enterotoxin (CPE). Sie wurden zunächst nicht als Claudine beschrieben, sondern als Rvp.1 (rat ventral prostrate, später umbenannt in Claudin 3) und CPE-R (Clostridium perfringens Enterotoxin Receptor, später umbenannt in Claudin 4). Die Bindung von CPE an Claudin 3 oder 4 führt innerhalb von zehn bis zwanzig Minuten zu einer Lyse der Claudin 3/Claudin 4 exprimierenden Zellen und dadurch zu einer Schädigung des Darmepithels, die sich in einem schweren Durchfall äußert.
Verschiedene Erkrankungen des Menschen sind auf Mutationen in Claudin-Genen zurückzuführen. So führen beispielsweise Mutationen in Claudin 16, das auch Paracellin heißt, zu einer vermehrten Calciumausscheidung im Harn (Hyperkalzurie) und zu einem Abfall des Magnesiumgehalts im Blut (Hypomagnesiämie).
Claudin 14 ist bei den Vertebrata (Wirbeltieren) in Leber und Niere, im Pankreas und im Innenohr exprimiert. Bei Mäusen konnte gezeigt werden, dass die Expression von Claudin 14 im Innenohr erst nach der Geburt beginnt. In zwei in Pakistan lebenden Familien wurden Mutationen identifiziert, die eine Verschiebung des Offenen Leserahmens bzw. ein Stopcodon erzeugen. Diese Mutationen führen rezessiv zu Taubheit, während die Nieren- und Leberfunktionen normal zu sein scheinen. Auch die entsprechenden Mausmutanten haben keine Defekte in Nieren- und Leberfunktion. Der in der Mausmutante genauer analysierte Phänotyp zeigte, dass die Haarzellen des Innenohrs degenerieren, wenn Claudin 14 in den Tight junctions des Innenohrs fehlt, was zum Verlust der Hörfunktion führt. Die Tight-junction-Stränge zwischen den äußeren Haarzellen und dem Cortischen Organ sind aber noch vorhanden und die Zellpolarität des Epithels ist nicht gestört. Die Degeneration der Haarzellen erfolgt vermutlich aufgrund von zu hohen Kalium-Konzentrationen während der frühen Entwicklung des Hörens.[8]
Claudin 11, das zunächst als OSP (Oligodendrocyte-specific Protein) bezeichnet wurde, ist hauptsächlich im Myelin des Zentralen Nervensystems (ZNS) und im Hoden exprimiert. Die Mausmutante weist eine verzögerte Reizweiterleitung in den Nerven auf und die Hinterbeine sind geschwächt. Die Männchen sind steril, aber die Mutante überlebt. Elektronenmikroskopische Gefrierbruch-Aufnahmen zeigen, dass im ZNS-Myelin und in Sertoli-Zellen keine Tight junctions zu finden sind.[9] Die Blut-Hoden-Schranke ist in diesen Mutanten defekt. Claudin 11 interagiert mit OAP (OSP/ Claudin 11- associated protein) und beta-1 Integrin in einem Komplex, der bei der Zelladhäsion und dem Integrin-Signaling eine Rolle spielt.
Claudin 19 ist im peripheren Nervensystem in den Schwannschen Zellen exprimiert, wo es Tight-junction-ähnliche Strukturen ausbildet. Mäusen, die im genomischen Bereich von Claudin 19 eine Deletion aufweisen, fehlen diese Strukturen, und sie haben eine gestörte Reizweiterleitung, wodurch der Bewegungsapparat beeinträchtigt wird.
Mäuse, denen Claudin 1 fehlt, sterben wenige Stunden nach der Geburt, weil sie austrocknen. Eine Mutation im humanen Claudin-1-Gen führt zu schweren Hautveränderungen. Mäuse, denen Claudin 5 fehlt, haben einen speziellen Phänotyp: ihre Blut-Hirn-Schranke wird für kleinere Moleküle durchlässig. Die Überexpression von Claudin 6 führt zu einer Fehlfunktion der Epidermis.
Bei diesen Beispielen wird deutlich, dass die Claudine entscheidende Funktionen zur Bildung einer funktionierenden parazellulären Barriere in verschiedenen Epithelien ausüben, und dabei in verschiedene Gruppen eingeteilt werden können: „housekeeping“-Claudine, die weitgehend ubiquitär exprimiert sind und Grundfunktionen für die Bildung der Tight-junction-Bänder übernehmen, und spezialisierte Claudine, die nur in bestimmten Geweben exprimiert werden oder nicht in allen Geweben, in denen sie vorkommen, eine essenzielle Funktion ausüben.
Literatur
- Christina M. Van Itallie, James M. Anderson: Claudins and Epithelial Paracellular Transport. In: Annual Review of Physiology. Bd. 68, 2006, S. 403-429, doi:10.1146/annurev.physiol.68.040104.131404.
- Julia E. Rasmussen: Claudins and regulation of the paracellular transport system. Dissertation (M.S.), The University of North Carolina at Chapel Hill, ProQuest Information and Learning, Publikationsnummer AAT 1432782. Chapel Hill 2006 (27. Oktober), ISBN 978-0-542-54616-7.
- Christina M. Van Itallie, James M. Anderson: Physiology and Function of the Tight Junction. In: Cold Spring Harbor Perspect Biol. Bd. 1, Nr. 2, August 2009, PMC 2742087 (freier Volltext).
Einzelnachweise
- C. Ruffer, V. Gerke: The C-terminal cytoplasmic tail of claudins 1 and 5 but not its PDZ-binding motif is required for apical localization at epithelial and endothelial tight junctions. In: European journal of cell biology. 83, 2004, ISSN 0070-2463, S. 135–144, PMID 15260435.
- Dorothee Günzel, Alan S. L. Yu: Claudins and the Modulation of Tight Junction Permeability. In: Physiological Reviews. Band 93, Nr. 2, April 2013, ISSN 0031-9333, S. 525–569, doi:10.1152/physrev.00019.2012, PMID 23589827, PMC 3768107 (freier Volltext).
- M. Furuse, K. Fujita, T. Hiiragi, K. Fujimoto, S. Tsukita: Claudin-1 and -2: novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin. In: Journal of Cell Biology. Bd. 141, 1998, S. 1539-1550, PMID 9647647
- M. Furuse, S. Tsukita: Claudins in occluding junctions of humans and flies. In: Trends in Cell Biology. Bd. 16, 2006, S. 181–188, PMID 16537104.
- O. R. Colegio, C. Van Itallie, C. Rahner, J. M. Anderson: Claudin extracellular domains determine paracellular charge selectivity and resistance but not tight junction fibril architecture. In: American Journal of Physiology-Cell Physiology. Bd. 284, 2003, S. C1346-C1354, PMID 12700140.
- E.E. Schneeberger: Claudins form ion-selective channels in the paracellular pathway. In: American Journal of Physiology-Cell Physiology. Bd. 284, 2003, ISSN 0363-6143, S. C1331-C1333, PMID 12734103.
- Proteindatenbank des Sanger-Institutes in Cambridge, England (Memento vom 7. Juli 2012 im Internet Archive)
- T. Ben-Yosef, I. A. Belyantseva, T. L. Saunders, E.D. Hughes, K. Kawamoto, C. M. Van Itallie, L. A. Beyer, K. Halsey, D.J. Gardner, E. R. Wilcox, J. Rasmussen, J. M. Anderson, D. F. Dolan, A. Forge, Y. Raphael, S. A. Camper, T. B. Friedman: Claudin 14 knockout mice, a model for autosomal recessive deafness DFNB29, are deaf due to cochlear hair cell degeneration. In: Human Molecular Genetics. Bd. 12, 2003, S. 2049–2061, PMID 12913076.
- A. Gow, C. M. Southwood, J. S. Li, M. Pariali, G. P. Riordan, S. E. Brodie, J. Danias, J. M. Bronstein, B. Kachar, R. A. Lazzarini: CNS myelin and sertoli cell tight junction strands are absent in Osp/claudin-11 null mice. In: Cell. Bd. 99, 1999, S. 649-659, PMID 10612400.