Chrysochromulina
Chrysochromulina ist eine Gattung von Haptophyten. Dieses Phytoplankton ist weltweit in Brack- und Meeresgewässern mit ca. 60 bekannten Arten (Spezies) verbreitet.[2][3] Alle Chrysochromulina-Arten sind phototroph, einige haben sich jedoch als mixotroph erwiesen und zeigen unter bestimmten Umweltbedingungen auch Phagotrophie.[3] Die Chrysochromulina-Zellen sind klein und werden typischerweise mit Hilfe der Elektronenmikroskopie beobachtet. Sie zeichnen sich durch Schuppen (englisch scales) aus.[2][3] Bei einigen Arten wurde nachgewiesen, dass sie unter bestimmten Umweltbedingungen toxische Verbindungen produzieren, die für größere Meereslebewesen einschließlich Fischen schädlich sind.[2][3][4]
| Chrysochromulina | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Chrysochromulina | ||||||||||||
| Lackey, 1939[1] |
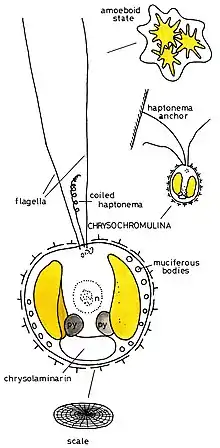
Morphologie
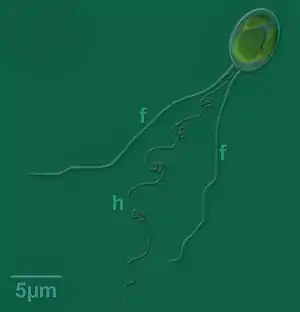
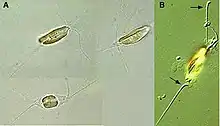
Die Individuen der Gattung sind, je nach Art (Spezies) zwischen 3,0 und 13,0 µm groß, wobei die größten Exemplare bei der Art C. polylepis zu finden sind.[2] Die Zelloberfläche ist mit plättchenförmigen Schuppen bedeckt, wobei oft zusätzliche Lagen verschiedener Schuppentypen übereinander liegen.[2]
Wie für alle Haptophyten charakteristisch, besitzen die Mitglieder der Gattung Chrysochromulina zwei Geißeln und ein einzigartiges geißelähnliches Organell, das als Haptonema bezeichnet wird.[5] Es gibt (zumindest für einige Arten) auch ein amöboides Stadium ohne Geißeln und Haptonema.[6]
Die Haptonema kann in ihrer Länge stark variieren und dabei bis zu 60 µm erreichen.[2] Sie unterscheidet sich von den Geißeln in Bezug auf die Anordnung der Mikrotubuli. Ihre Funktion ist die der Zellanhaftung und Nahrungsaufnahme.[5]
Genomsequenzierung
Haptophyten haben eine Evolutionsgeschichte von etwa 1,2 Milliarden Jahren, Belege aus Mikrofossilien unterstützen diese Ansicht.[7]
Im Jahr 2014 wurde der Entwurf der Genomsequenz von C. tobinii von Forschern der University of Washington veröffentlicht.[7][8] Es war das erste vollständig sequenzierte Genom eines Mitglied der Ordnung Prymnesiales. Man erhofft sich davon ein breites Verständnis der Evolutionsgeschichte der Haptophyten und der Diversität dieser Algenklade. Darüber hinaus kann dies bei der Erforschung bestimmter Gene und Proteine helfen, die für die Bildung von Toxinen und die Freisetzung anderer Chemikalien verantwortlich sind.[8]
Arten
Viele früher zur Gattung Chrysochromulina gestellte Spezies werden inzwischen den Gattungen Haptolina oder Prymnesium zugeordnet. Aktuell gehören damit (noch) zur Gattung Chrysochromulina folgende Spezies:[9][10][11][12][13]
Gattung Chrysochromulina Lackey, 1939
- C. acantha Leadbeater & Manton, 1971(ANWµ)
- C. adriatica Leadbeater, 1974(Aµ)
- C. ahrengotii M.Ø.Jensen & Moestrup, 1999(Aµ)
- C. alifera Parke & Manton 1956(ANµ)
- C. andersonii T.Yuasa, M.Kawachi, T.Horiguchi & O.Takahashi, 2019(AN)
- C. apheles Moestrup & H.A.Thomsen, 1986(ANµ)
- C. bergensis Leadbeater, 1972(W) mt offensichtlichem(? unbestätigter Lapsus Calami) Synonym C. bergenensis Leadbeater 1972(AWµ)
- C. birgeri Hällfors & Niemi, 1974(WNµ)
- C. brachycylindra Hällfors & Thomson, 1986(Aµ)
- C. breviturrita K.H.Nicholls 1978(Aµ)
- C. camella Leadbeater & Manton, 1969(AN)
- C. campanulifera Manton & Leadbeater, 1974(ANµ)
- C. cyathophora Thomsen, 1979(Aµ)
- C. cymbium Leadbeater & Manton, 1969(ANµ)
- C. discophora Manton, 1983(Aµ)
- C. elegans Estep, Davis, Hargraves & Sieburth, 1984(AN)
- C. ephippium Parke & Manton, 1956(Aµ)
- C. fragilis Leadbeater, 1972(Aµ)
- C. inornamenta D.Wujek & W.E.Gardiner 1985(Aµ)
- C. lanceolata Chrétiennot-Dinet, Nezan & Puigserver, 2003(Aµ)
- C. latilepis Manton 1982(A)
- C. leadbeateri Estep, Davis, Hargreaves & Sieburth, 1984(ANµ)
- C. mactra Manton, 1972(Aµ)
- C. mantoniae Leadbeater, 1972(Aµ)
- C. megacylindra Leadbeater, 1972(Aµ)
- C. microcylindra Leadbeater, 1972(Aµ)
- C. novae-zelandiae Moestrup, 1979(A)
- C. orbiculata Rouchijajnen 1972(A)
- C. pachycylindra Manton & Oates 1981(A)
- C. papillata Gao, Y., C.K.Tseng & Y.Guo, 1993(A)
- C. parkeae J.C.Green & Leadbeater, 1972(ANµ)

- C. parva Lackey 1939 (Typus)(ANµ)
- C. pelagica Estep et al. 1984(A)
- C. planisquama Hu, Yin & Tseng, 2005(Aµ)
- C. pontica Rouchijajnen 1966(A)
- C. pringsheimii Parke & Manton, 1962(Aµ)
- C. pseudolanceolata Chrétiennot-Dinet & Puigserver, 2003(Aµ)
- C. pyramidosa H.A.Thomsen, 1977(Aµ)
- C. quadrikonta M.Kawachi & I.Inouye, 1993(Aµ)
- C. rotalis Eikrem & Throndsen, 1999(ANµ)
- C. simplex Estep, P.G.Davis, P.E.Hargraves & Sieburth, 1985(ANµ)
- C. spinifera (Fournier) Pienaar & R.E.Norris, 1979(Aµ)
- C. strobilus Parke & Manton, 1959(ANµ)
- C. tenuispina Manton, 1978(Aµ)
- C. tenuisquama Estep et al.(A)
- C. throndsenii Eikrem, 1996(ANµ)
- C. tobinii Cattolico 2019(AN)
- C. vexillifera Manton & Oates, 1983(A)
unsichere Mitglieder:
bisher lediglich vorgeschlagene Mitglieder:
Neu der Gattung Haptolina zugeordnet (nach WoRMS):
- C. brevifilum(µ) als H. brevifila(W)
- C. ericina(µ) als H. ericina(W)
- C. fragaria(µ) als H. fragaria(W)
- C. herdlensis(µ) als H. herdlensis(W)
- C. hirta(µ) als H. hirta(W)
Neu der Gattung Prymnesium zugeordnet (nach WoRMS):
Ökologische Bedeutung
Chrysochromulina spielt eine wesentliche Rolle bei der globalen Kohlenstoffbindung und der Bildung toxischer Algenblüten in den Weltmeeren. Die meisten Haptophyten sind photosynthetische Mikroalgen, aber einige von ihnen sind mixotroph.[7] Haptophyten können sowohl in Süß- als auch in Meerwassersystemen leben. Diese kombinierte Lebensweise macht Haptophyten zu effizienten Organismen in der globalen Kohlenstofffixierung, sie nehmen 30 bis 50 % der photosynthetischen Biomasse im Ozean ein.[17]
Toxikologie
Einige Arten, wie z. B. C. polylepis, produzieren ein kohlenstoffreiches, membranschädigendes Toxin.[4] Studien legen einen Zusammenhang zwischen der Stickstoff- und Phosphor-Zusammensetzung in der marinen Umgebung und der Toxinproduktion dieser Haptophyten nahe. Nach früheren Aufzeichnungen fielen hohe Nitratwerte in Kombination mit einer niedrigen Phosphorkonzentration zusammen mit einem Anstieg der Toxizität während Algenblüten.[18] Weitere Forschungen haben inzwischen ergeben, dass sowohl niedrige Stickstoff- als auch niedrige Phosphorwerte in den Zellen zu einem Anstieg der Toxinproduktion führen können, wobei sich Phosphor als die etwas einflussreichere Komponente erwies.[4]
Trotz dieser Korrelation ist es unwahrscheinlich, dass Stickstoff oder Phosphor in direktem Zusammenhang mit der Toxinbildung stehen, da die Toxine selbst stark kohlenstoffbasiert sind. Darüber hinaus sind auch andere wachstumsbegrenzende Faktoren wie Licht und Salzgehalt dafür bekannt, die Toxizität zu erhöhen, was darauf hindeutet, dass die Toxine in Zeiten geringen Wachstums einen selektiven Vorteil für die Verteidigung der Einzeller haben. Studien unterstützen die Idee, dass die Toxinproduktion eine Stoffwechselreaktion auf zellulären Stress aufgrund von Nährstoffeinschränkungen darstellt.[4]
Chrysochromulina-Algenblüten
Viele Chrysochromulina-Arten bilden weltweit Algenblüten.[19] Bei einigen dieser Blüten im Nordatlantik können Verbindungen produziert werden, die unter den bestimmten Umweltbedingungen für andere Meeresorganismen giftig sind.[3][19][20] In den skandinavischen Küstengewässern bilden sich die Blüten gewöhnlich zwischen April und August, wobei die spezifischen Chrysochromulina-Arten von Jahr zu Jahr variieren.[3][19]
Algenblüte 1988
Im späten Frühjahr 1988 gab es eine Chrysochromulina-Blüte, die sich vom Kattegat bis zum Skagerrak ausbreitete, gebildet nur aus einer einzigen Art, C. polylepis.[19][20] Diese spezielle Blüte war aufgrund der Produktion von hämolytischen Verbindungen durch C. polylepis toxisch für andere Meeresorganismen, einschließlich Protozoen, Wirbellose und 900 Tonnen Zuchtfischen.[19][20]
C. polylepis ist in den in der Region üblichen Konzentrationen normalerweise nicht toxisch. Es wird jedoch angenommen, dass bestimmte Umweltbedingungen wie eine starke Schichtung mit einer warmen Oberflächenschicht und niedrigem Salzgehalt nach einem Winter mit hohen Stickstoffabflüssen, zu einem erhöhten N:P-Verhältnis führten, was dann zu der beobachteten staken Algenblüte führte.[3][19][20]
Es wird auch angenommen, dass die Produktion dieser toxischen Verbindungen das Abweiden von C. polylepis durch Fressfeinde einschränkte, so dass die Blüte von dieser einzigen Art dominiert wurde.[19] Die toxischen Effekte schienen sich später schnell wieder umzukehren und das Nahrungsnetz war bis 1993 dort wiederhergestellt.[19][20]
Kattegat-Algenblüte 1992
Von April bis Mai 1992 gab es im südlichen Kattegat eine große Blüte, die aus vielen Phytoplanktonarten bestand, wobei über 90 % der Biomasse Chrysochromulina-Arten waren (allerdings inzwischen z. T. der Gattung Haptolina zugeordnet).[21] Die am häufigsten vorkommenden Arten in der Blüte waren:[21]
- C. spinifera,
- Haptolina hirta (früher C. hirta),
- H. ericina (früher C. ericina),
- H. brevifila (früher C. brevifilum), sowie
- eine unbeschriebene Art (Ø. Moestrup).
C. spinifera, H. hirta und H. ericina zeichnen sich durch relativ kleine Zellen mit langen Dornen aus, die den Gesamtorganismen einen Durchmesser von 25–76 μm verleihen, was für die vorhandenen Ciliaten (als potentielle Fressfeinde) zu groß ist, um sie zu verschlingen; wahrscheinlich ein Grund für den „Erfolg“ der Blüte war.[21]
Es gab keine Beweise, die diese Blüte oder die vorhandenen Arten direkt mit der Produktion von Toxinen (wie bei der C. polylepis-Blüte 1988) in Verbindung brachten.[20][21] Es wurden jedoch etwa 50 Tonnen toter Regenbogenforellen (Oncorhynchus mykiss) in Verbindung mit der Blüte gebracht.[21]
Viren
Folgende Viren wurden assoziiert mit Chrysochromulina-Spezies gefunden:
- Chrysochromulina brevifilum virus PW1 (CbV-PW1), Gattung Prymnesiovirus in der Familie Phycodnaviridae[22][23]
- „Chrysochromulina parva virus BQ1“ (CpV-BQ1), mutmaßliches Mitglied der Familie Phycodnaviridae ohne Gattungszuordnung[24][25]
- „Chrysochromulina parva virus BQ2“ (CpV-BQ2), mutmaßliches Mitglied des Phylums Nucleocytoviricota (NCLDV)[23]
- „Chrysochromulina parva virophage“, ein Virophage gefunden im Süßwasser, USA[26][23]
Wegen der Neuzuordnung seines Wirtes zur Gattung Haptolina nicht mehr unter die Chrysochromulina-Parasiten klassifiziert wird der Kandidat
- „Chrysochromulina-ericina-Virus 01B“ (CeV-01B)[27] alias „Haptolina-ericina-Virus 01B“ (HeV-01B), Klasse Megaviricetes
CpV-BQ1 wurde isoliert, indem Süßwasserproben aus dem Ontariosee gefiltert und mittels Transmissionselektronenmikroskopie analysiert analysierte. CpV-BQ1 ist ein ikosaedrisches Virus des Phylums Nucleocytoviricota (NCLDV, nucleocytoplasmic large DNA virus) mit einer Genomgröße von 485 kbp (Kilobasenpaaren). Es ist ein Mitglied der Klasse Megaviricetes (früher vorgeschlagene Ordnung Megavirales) mit Merkmalen der Familien Phycodnaviridae und Mimiviridae. Die Konzentrationen von Chrysochromulina im Ontariosee erwiesen sich als konsistent, während die Konzentrationen von CpV-BQ1 stark variierten.[25]
Einzelnachweise
- J.B. Lackey: Notes on plankton flagellates from the Scioto River (with descriptions of new forms). In: Lloydia. 2, 1939, S. 128–143.
- Marie-Josèphe Chrétiennot-Dinet, Nicolas Desreumaux, Régine Vignes-Lebbe: An interactive key to the Chrysochromulina species (Haptophyta) described in the literature. In: PhytoKeys. Nr. 34, 13. Februar 2014, S. 47–60. doi:10.3897/phytokeys.34.6242. PMID 24596492. PMC 3941069 (freier Volltext).
- Einar Dahl, Espen Bagøien, Bente Edvardsen, Nils Chr. Stenseth: The dynamics of Chrysochromulina species in the Skagerrak in relation to environmental conditions. In: Journal of Sea Research. 54, Nr. 1, Juli 2005, S. 15–24. bibcode:2005JSR....54...15D. doi:10.1016/j.seares.2005.02.004.
- N. Johansson, E. Granéli: Cell density, chemical composition and toxicity of Chrysochromulina polylepis (Haptophyta) in relation to different N:P supply ratios. In: Marine Biology. 135, Nr. 2, November 1999, S. 209–217. doi:10.1007/s002270050618.
- Robert A. Andersen: Biology and systematics of heterokont and haptophyte algae. In: American Journal of Botany. 91, Nr. 10, 1. Oktober 2004, ISSN 1537-2197, S. 1508–1522. doi:10.3732/ajb.91.10.1508. PMID 21652306.
- Allan Pentecost: Diagnostic Drawing: Prymnesiophyceae non calcified, Diagnostic Drawings (Part 2), Agricultural & Environmental Data Archive (AEDA), 14. Oktober 2008
- Blake T. Hovde, Shawn R. Starkenburg, Heather M. Hunsperger, Laina D. Mercer, Chloe R. Deodato, Ramesh K. Jha, Olga Chertkov, Raymond J. Monnat, Rose Ann Cattolico: The mitochondrial and chloroplast genomes of the haptophyte Chrysochromulina tobin contain unique repeat structures and gene profiles. In: BMC Genomics. 15, 17. Juli 2014, ISSN 1471-2164, S. 604. doi:10.1186/1471-2164-15-604. PMID 25034814. PMC 4226036 (freier Volltext).
- Blake T. Hovde, Chloe R. Deodato, Heather M. Hunsperger, Scott A. Ryken, Will Yost, Ramesh K. Jha, Johnathan Patterson, Raymond J. Monnat Jr, Steven B. Barlow: Genome Sequence and Transcriptome Analyses of Chrysochromulina tobin: Metabolic Tools for Enhanced Algal Fitness in the Prominent Order Prymnesiales (Haptophyceae). In: PLOS Genetics. 11, Nr. 9, 23. September 2015, ISSN 1553-7404, S. e1005469. doi:10.1371/journal.pgen.1005469. PMID 26397803. PMC 4580454 (freier Volltext).
- AlgaeBase: Chrysochromulina Lackey, 1939
- NCBI: Chrysochromulina (genus); graphsich: Chrysochromulina, auf: Lifemap, NCBI Version.
- Nordic Microalgae: Chrysochromulina Lackey, auf: Nordic Microalgae and aquatic protozoa, Swedish Meterological and Hydrological Institute (SMHI)
- WoRMS: Chrysochromulina Lackey, 1939
- Chrysochromulina, Encyclopedia of Life
- Skinnerflo, Store norske leksikon
- Fishing in Skinnerflo
- NCBI: unclassified Chrysochromulina (list)
- Hui Liu, Ian Probert, Julia Uitz, Hervé Claustre, Stéphane Aris-Brosou, Miguel Frada, Fabrice Not, Colomban de Vargas: Extreme diversity in noncalcifying haptophytes explains a major pigment paradox in open oceans. In: Proceedings of the National Academy of Sciences. 106, Nr. 31, 4. August 2009, S. 12803–12808. bibcode:2009PNAS..10612803L. doi:10.1073/pnas.0905841106. PMID 19622724. PMC 2722306 (freier Volltext).
- Lars Fredrik Skau, Tom Andersen, Jan-Erik Thrane, Dag Olav Hessen: Growth, stoichiometry and cell size; temperature and nutrient responses in haptophytes. In: PeerJ. 5, 5. September 2017, S. e3743. doi:10.7717/peerj.3743. PMID 28890852. PMC 5590550 (freier Volltext).
- Jakob Gjøsæter, Kyrre Lekve, Nils Chr. Stenseth, Hans Petter Leinaas, Hartvig Christie, Einar Dahl, Didrik S. Danielssen, Bente Edvardsen, Frode Olsgard: A long-term perspective on the Chrysochromulina bloom on the Norwegian Skagerrak coast 1988: a catastrophe or an innocent incident?. In: Marine Ecology Progress Series. 207, 22. November 2000, ISSN 0171-8630, S. 201–218. bibcode:2000MEPS..207..201G. doi:10.3354/meps207201.
- Torkel Gissel Nielsen, Thomas Kiørboe, Peter Koefoed Bjørnsen: Effects of a Chrysochromulina polylepis subsurface bloom on the planktonic community. In: Marine Ecology Progress Series. 62, Nr. 1/2, 5. April 1990, S. 21–35. bibcode:1990MEPS...62...21N. doi:10.3354/meps062021.
- Per Juel Hansen, Torkel Gissel Nielsen, Hanne Kaas: Distribution and Growth of Protists and Mesozooplankton during a Bloom of Chrysochromulina Spp. (Prymnesiophyceae, Prymnesiales). In: Phycologia. 34, Nr. 5, 1995, S. 409–416. doi:10.2216/i0031-8884-34-5-409.1. Epub 22. April 2019. Freier Volltext (ResearchGate)
- ICTV: ICTV Taxonomy history: Chrysochromulina brevifilum virus PW1
- Joshua M. A. Stough, Natalya Yutin, Yuri V. Chaban, Mohammed Moniruzzaman, Eric R. Gann, Helena L. Pound, Morgan M. Steffen, Jenna N. Black, Eugene V. Koonin, Steven W. Wilhelm, Steven M. Short: Genome and Environmental Activity of a Chrysochromulina parva Virus and Its Virophages, in: Front. Microbiol., 5. April 2019, doi:10.3389/fmicb.2019.00703
- NCBI: Chrysochromulina parva virus BQ1 (species)
- S. F. Mirza, M. A. Staniewski, C. M. Short, A. M. Long, Y. V. Chaban, S. M. Short: Isolation and characterization of a virus infecting the freshwater algae Chrysochromulina parva. In: Virology. 486, Dezember 2015, S. 105–115. doi:10.1016/j.virol.2015.09.005. PMID 26432023.
- Christopher M. Bellas, Ruben Sommaruga: Polinton-like viruses are abundant in aquatic ecosystems. In: Microbiome. Band 9, Nr. 13, 12. Januar 2021, doi:10.1186/s40168-020-00956-0.
- Lucie Gallot-Lavallée, António Pagarete, Matthieu Legendre, Sebastien Santini, Ruth-Anne Sandaa, Heinz Himmelbauer, Hiroyuki Ogata, Gunnar Bratbak, Jean-Michel Claverie: The 474-Kilobase-Pair Complete Genome Sequence of CeV-01B, a Virus Infecting Haptolina (Chrysochromulina) ericina (Prymnesiophyceae). In: Genome Announcements. 3, Nr. 6, 3. Dezember 2015. doi:10.1128/genomeA.01413-15. PMID 26634761. PMC 4669402 (freier Volltext).