Brivudin
Brivudin ist ein Arzneistoff, der als Virostatikum gegen Herpes simplex Typ 1 und Herpes Zoster eingesetzt werden kann. Es gehört zur Gruppe der Nukleosidanaloga. Im Vergleich zu anderen Nukleosidanaloga (Aciclovir, Valaciclovir, Famciclovir) zeichnet es sich durch eine wesentlich (200- bis 1000-fach) höhere antivirale Potenz aus und durch eine lange Halbwertszeit sowie intrazelluläre Verweildauer. Die häufigste Nebenwirkung ist Übelkeit, insgesamt sind Nebenwirkungen aber selten.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
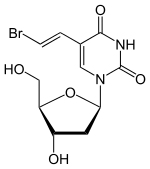 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Brivudin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C11H13BrN2O5 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
J05AB15 | |||||||||||||||
| Wirkstoffklasse |
Nukleosidanaloga | |||||||||||||||
| Wirkmechanismus |
Hemmung der viralen DNA-Polymerase | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 333,135 g·mol−1 | |||||||||||||||
| Schmelzpunkt |
164–166 °C[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Brivudin wurde schon in den 1970er Jahren in England und der damaligen DDR hergestellt. Aber erst seit einer Indikationsänderung im Jahr 2001 findet es breitere Verwendung. Bis zum Jahr 2000 war es zur Therapie von Herpes-simplex-Infektionen zugelassen. Seit 2001 wird es zur Behandlung von Herpes zoster angewendet.
Pharmakologie
Wirkmechanismus
Brivudin ist ein Thymidin-Antimetabolit, es wirkt gegen DNA-Viren.
In mehreren Phosphorylierungsschritten wird Brivudin zum Triphosphat aktiviert. Die Aktivierung erfolgt nur in der virusinfizierten Zelle, weil der Vorgang durch eine virale Thymidinkinase katalysiert wird. Die Triphosphate stellen die eigentliche Wirkform dar. Sie führen zur Hemmung der viralen DNA-Polymerase, zum Einbau von veränderten Nukleinbasen in die DNA und folglich zum Kettenabbruch während der DNA-Elongation.
Brivudin-Triphosphat hat eine sehr lange intrazelluläre Verweildauer von 10 Stunden, so dass es auch genug Zeit hat, um seine Wirkung in der von Viren befallenen Zellen zu entfalten. Da Brivudin nur die Virusreplikation hemmt, aber nicht das Virus selbst schädigt, kann es nur den Infektionsablauf unterdrücken. Es kann aber keine Erregereradikation bewirken und die für Herpesviren typischen Rezidive nicht verhindern.
Wirkspektrum
Brivudin hat eine hohe Aktivität gegen Herpesviren. Es ist wirksam gegen Herpes simplex Typ 1 und gegen Varicella-Zoster-Viren. Dagegen ist es gegen Herpes simplex Typ 2 (z. B. genitale Infektionen) kaum wirksam. In vitro ist Brivudin auch gegen das Epstein-Barr-Virus wirksam. Eine Fallstudie zur Behandlung einer EBV-Enzephalitis bestätigte die Wirksamkeit auch in vivo.[3]
Wirksamkeit
Brivudin ist wesentlich stärker gegen Herpesviren wirksam als andere Nukleosidanaloga (z. B. Aciclovir). Als Kriterium wird die Zeit vom Beginn der Behandlung bis zum letztmaligen Auftreten neuer Bläschen herangezogen. Bei Aciclovir beträgt diese Zeitspanne 18 Stunden, bei Brivudin 13 bis 14 Stunden.
Darüber hinaus tritt die postzosterische Neuralgie (= Neuralgie im Anschluss an eine Herpes-zoster-Erkrankung) nach einer Behandlung mit Brivudin signifikant seltener (ca. 25 %) auf als nach einer Behandlung mit Aciclovir oder Famciclovir.
Die signifikant bessere Wirksamkeit von Brivudin gegenüber Aciclovir ist umstritten. Das arznei-telegramm verweist auf mögliche Interessenskonflikte der Verfasser der Brivudin-favorisierenden AWMF-Leitlinie und bezweifelt die klinische Relevanz der maßgeblichen Studien.[4]
Indikationen und Dosierung
Brivudin ist indiziert bei Herpes zoster und Herpes simplex Typ 1. Insbesondere bei Patienten über 50 Jahren ist es für diese Indikation das Mittel der Wahl.
Es wird oral angewendet. Die Standarddosierung beim Erwachsenen beträgt 125 mg pro Tag über 7 Tage. Die Tablette soll jeden Tag ungefähr zum gleichen Zeitpunkt eingenommen werden. Bei Patienten mit Nieren- oder Leberinsuffizienz ist keine Dosisanpassung nötig.[5]
Wichtig für den Behandlungserfolg ist, dass die Therapie möglichst innerhalb von 72 Stunden nach dem Beginn der Hautsymptomatik erfolgt (= Phase der Virusreplikation). Ein späterer Behandlungsbeginn ist noch sinnvoll, solange noch frische Bläschen vorhanden sind, wenn sich Anzeichen einer viszeralen Ausbreitung zeigen oder bei floridem Zoster ophthalmicus und Zoster oticus.
Nebenwirkungen
Brivudin wird meistens gut vertragen. Die häufigsten Nebenwirkungen betreffen den Gastrointestinaltrakt: bei 2 % der Patienten kommt es zu Übelkeit. Auch eine Diarrhoe (Durchfall) kann auftreten.
Seltene Nebenwirkungen sind:
- Störungen des Nervensystems: Kopfschmerzen, Schwindel etc.,
- Müdigkeit oder Schlafstörungen,
- Anstieg von Serum-Kreatinin und -harnstoff (Hinweise auf Einschränkung der Nierenfunktion),
- Überempfindlichkeitsreaktionen der Haut,
- Blutbildveränderungen (reversibel).
Wechselwirkungen und Anwendungsbeschränkungen
- Brivudin darf nicht gleichzeitig oder zeitnah mit dem Zytostatikum 5-Fluoruracil oder anderen 5-Fluorpyrimidinen (z. B. Tegafur) verabreicht werden. Mindestens 4 Wochen müssen zwischen der Gabe dieser Medikamente liegen, da der Metabolit des Brivudins, Bromvinyluracil, irreversibel das Enzym Dihydropyrimidindehydrogenase hemmt, das für den Abbau von Pyrimidinen zuständig ist. Das führt zu einer Kumulation und erhöhten Toxizität von 5-Fluoruracil, verbunden mit der Gefahr schwerer Nebenwirkungen: erhebliche gastrointestinale Störungen, Neutropenie und Knochenmarksdepression. Bei der gleichzeitigen Gabe von 5-Fluoruracil und Sorivudin, welches so wie Brivudin zum Metaboliten Bromvinyluracil abgebaut wird, hat diese Interaktion sogar zu Todesfällen geführt.[6] Diese potenziell tödliche Wechselwirkung mit antineoplastisch (5-Fluorouracil, Capecitabin, Floxuridin, Tegafur) oder antimykotisch wirksamen 5-Fluoropyrimidinen (5-Fluorcytosin) ist prinzipiell auch für Brivudin bedeutsam.[7]
- Mit Datum vom 12. Mai 2020 erschien ein weiterer Rote-Hand-Brief mit folgendem Inhalt: "Es können Todesfälle infolge einer Arzneimittelwechselwirkung zwischen Brivudin und Fluoropyrimidinen (z. B. Fluorouracil (5-FU), Capecitabin, Tegafur, Flucytosin) auftreten. Nach Abschluss der Brivudin-Behandlung muss eine mindestens vierwöchige Wartezeit, eingehalten werden, bevor die Behandlung mit einem Fluoropyrimidin begonnen werden kann. In vielen Fällen kam es zu Todesfällen, wenn diese vierwöchige Wartezeit nicht eingehalten wurde (z. B. wurde Brivudin zwischen zwei 5-FU-Zyklen eingenommen)."[8]
- Verdrängung von Brivudin aus der Plasmaeiweißbindung durch andere Medikamente mit ebenfalls starker Eiweißbindung.
Kontraindikationen
- Schwangerschaft und Stillzeit
- gleichzeitige Gabe von 5-Fluoruracil (siehe vorstehend bei Wechselwirkungen und Anwendungsbeschränkungen)
- Immunsuppression
Kreuzresistenz
Eine Kreuzresistenz besteht mit Aciclovir bei Herpes-simplex- und Varicella-Zoster-Viren.
Pharmakokinetik
- Orale Bioverfügbarkeit: 30 % (wegen ausgeprägtem First-Pass-Effekt)
- Absorption: 85 %
- Terminale Halbwertszeit: 16 Stunden
- Ausscheidung: hauptsächlich renal, 20 % via Faeces
Brivudin wird nach oraler Gabe fast vollständig enteral resorbiert. Der maximale Plasmaspiegel wird schon nach 1 Stunde erreicht. Mahlzeiten verzögern die Resorption, senken aber die Resorptionsquote selbst nicht. Bei der First-pass-Metabolisierung entsteht zu ca. 65 % der nicht wirksame Metabolit Bromovinyluracil (BVU). Diese unwirksame Substanz entsteht durch das Enzym Pyrimidinphosphorylase, das die Zuckerkomponente abspaltet. Brivudin wird zu über 95 % an Plasmaproteine gebunden, das Verteilungsvolumen beträgt 75 Liter. Bei einer eingeschränkten Nierenfunktion kommt es zu einer deutlichen Verlängerung der Halbwertszeit.
Siehe auch
Literatur
- Wehling, Martin – Klinische Pharmakologie
- Karow, Thomas – Pharmakologie und Toxikologie
- Kojda, Georg – Pharmakologie / Toxikologie
- Austria-Codex 2005/2006 Fachinformation zu Mevir®
- Ärzte Zeitung, 16. Januar 2004
- Zeitschrift für Chemotherapie. Heft 3/2003 HTML
- Österreichische Apothekerzeitung: Herpes zoster innovativ behandelt: Mevir (Memento vom 26. März 2009 im Internet Archive), Heft 21/2003
Einzelnachweise
- Eintrag zu Brivudin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juni 2019.
- Datenblatt (E)-5-(2-Bromovinyl)-2′-deoxyuridine bei Sigma-Aldrich, abgerufen am 17. Dezember 2012 (PDF).
- Epstein-Barr virus encephalitis after kidney transplantation and successful treatment with brivudine, abgerufen am 11. Juli 2017.
- arznei-telegramm (5/2007): Brivudin (Zostex) besser als Aciclovir (Zovirax a.a.)?
- Austria-Codex Fachinformation 2005/2006 zu Mevir®.
- UAW – Aus Fehlern lernen - Potenziell tödlich verlaufende Wechselwirkung zwischen Brivudin (Zostex®) und 5-Fluoropyrimidinen (PDF; 36 kB), Deutsches Ärzteblatt, Jg. 103, Heft 27, 7. Juli 2006, abgerufen auf der WebSite der AkdÄ.
- Rote-Hand-Brief von Berlin Chemie / Menarini vom 27. August 2012. (PDF) Abgerufen am 4. September 2012.
- Gelbe Liste Online: Rote-Hand-Brief zu brivudinhaltigen Arzneimitteln | Gelbe Liste. Abgerufen am 12. Mai 2020.
Alle Produkte werden durch die Berlin Chemie AG hergestellt. In Griechenland, Österreich und der Schweiz werden sie vom Mutterkonzern Menarini vertrieben.